
搜索网站、位置和人员

电话: +86-(0)571-86886861 公共事务部
2022年12月19-22日,第十三届华人生物学家协会(Chinese Biological Investigators Society,“CBIS”),以“Enhancing and Reconnecting Biological Research in the Post-Pandemic Era”为主题,这场国际生物界重大学术盛会,在中国杭州、美国拉斯维加斯双会场成功同步举办。
本次双年会采用线上线下相结合的形式,邀请了来自世界多个国家和地区的生命科学领域的专家学者,带来100余场专题学术报告,共同探讨各个专家学者在生命科学领域的最新进展,在探索揭示生命现象和生命本质的进程中完美落幕。
12.20 Keynote Lecture
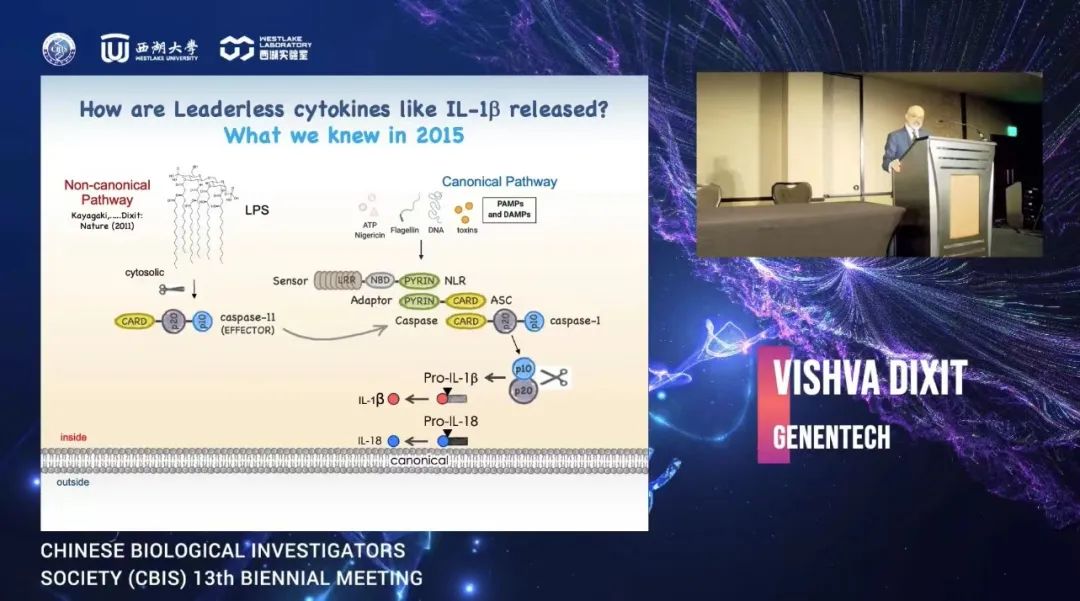
本环节第一位报告是来自拉斯维加斯分会场的Vishva M. Dixit教授,作为一名病理学家,他对细胞死亡和炎症信号的分子机制研究做出了巨大的贡献。他的突破性发现是,半胱氨酸蛋白酶(caspase)是死亡受体诱导细胞凋亡通路的组成部分。揭示了gasdermin D(GSDMD)是Caspase诱导细胞焦亡所必须的,Dixit教授证明了GSDMD是Caspase-11的底物。其中NINJ1(一种具有两个跨膜区域的细胞表面蛋白)在PMR(质膜破裂)的诱导中起着至关重要的作用。随机诱变小鼠的前向筛选将NINJ1与PMR联系起来。Ninj1–/–巨噬细胞对细胞焦亡、坏死性和凋亡性细胞死亡的多种诱导物表现出PMR受损,并且未能释放大量细胞内蛋白。Ninj1–/–巨噬细胞发生死亡,但具有独特且持续的气球状形态,这是由于气泡状突出的崩解不良。从机理上讲,NINJ1利用进化上保守的胞外域进行寡聚化和随后的PMR。NINJ1作为PMR的介导分子的发现推翻了长期存在的教条,即与细胞死亡相关的PMR是被动事件。

第二位报告者是杭州会场来自于中国科学院分子细胞科学卓越创新中心的陈玲玲研究员,她的主要研究方向是RNA代谢与功能,包括环形RNA与长非编码RNA。在本次报告中,陈玲玲研究员首先介绍了长非编码RNA的生成、亚细胞定位、转录水平和转录后水平的基因调控功能与机制,并且探讨了长非编码RNA在疾病发生发展中的功能和潜在应用。核仁是哺乳动物细胞核内最大的无膜细胞亚结构,其主要功能是产生并加工核糖体RNA,从而形成成熟的核糖体,参与蛋白质的翻译。以长非编码RNA SLERT为例,她介绍了该RNA分子的发现以及以低剂量分子伴侣机制调控核仁结构及RNA聚合酶Ⅰ转录的功能。此外,她们团队系统解析了人类核仁的超微三维结构以及rDNA的排布,提出了相分离促进新生成rRNA前体定向转运的模型,并发现了rRNA前体定向转运过程可以促进核仁DFC的组装,从而为RNA定位调控机制的研究提供了新思路。她们的团队为发现新的RNA及发现新的RNA功能做出了巨大的贡献,她们期望能够为生物医学带来新的生物机理和翻译潜力。
12.20 Session 2
Cancer, Metabolism and Regeneration

来自西湖大学的蔡尚研究员致力于研究乳腺干细胞以及乳腺肿瘤干细胞在乳腺发育、乳腺癌发生发展过程中的作用。本场报告蔡尚分享了团队首次证实的乳腺组织中存在的多种“胞内菌”在肿瘤转移定植过程中起到关键作用。蔡尚团队发现“胞内菌”通过重塑肿瘤细胞的细胞骨架,帮助肿瘤细胞抵抗血管里的压力,避免转移过程中受到的损伤。最后,蔡尚提出,细菌有可能通过免疫干预、压力调控、进化效率及代谢方式等来影响肿瘤细胞。这些成果有望为乳腺癌的临床治疗提供新的思路。

来自中南大学湘雅三院的吕奔教授不仅是一位科研工作者,也是一位医生。他关注的是程序性细胞死亡(Programmed Cell Death, PCD)如何影响临床上带来大量急性死亡的败血症(Sepsis)和热射病(Heat Stroke)。
吕教授的团队发现,革兰氏阴性菌感染时产生的LPS可以和细胞死亡产生的HMGB1蛋白结合进入细胞内部,进一步激活CASP11介导的细胞死亡以及弥散性血管内凝血,继而诱发病人的急性休克死亡。经过针对HMGB-CASP11这一通路的药物筛选,他们发现肝素Heparin可以通过一种非抗凝血机制来降低Sepsis带来的死亡,为临床治疗提供了方案。
今年夏天的持续高温,使得热射病进入大众的焦点,而这一疾病中发生的弥散性血管内凝血以及多器官衰竭也和PCD紧密相关。在热压力状态下,PCD相关的ZBP1蛋白可以在不结合核酸的情况下诱发细胞死亡、弥散性血管内凝血、器官损伤,这一过程和Ripk3基因的激活表达相关。而无论是Ripk3还是Zbp1的缺失都可以使实验动物免于热压力带来的死亡,这为热射病的治疗提供了靶点。
12.20 Session 3 Infection and Immunity

来自中科院上海生化细胞所的许琛琦研究员和西湖大学的周挺研究员共同主持了“感染与免疫”专题。
来自中科院上海生化细胞所的许琛琦研究员以提高CD3多样性为主题,对更有效的CAR-T设计进行了分享,并在最后介绍了其疫苗免疫相关工作。嵌合抗原受体T细胞(CAR-T)疗法是利用基因编辑使得工程化后的T细胞可专门识别特定抗原,还同时兼备共刺激分子,使得T细胞在识别携带特定抗原的细胞后更有效地执行杀伤功能。CAR-T疗法在血液瘤中取得了很好的效果,已被FDA批准用于特殊的B细胞瘤的治疗。但是CAR-T疗法对实体瘤效果不佳,在临床应用中许多患者肿瘤复发及严重的细胞因子毒性等问题尚未解决。TCR与CAR基础性的区别在于其组成成分CD3的多样性,因此他们基于前期的相关研究结果开发了融合CD3ε分子二代CAR,实验结果表明此种嵌合方式改善了CAR-T在慢性抗原刺激下“耗竭”(exhaustion)的情况,使得这种CAR-T具有更持久的肿瘤杀伤效果。在随后的第二部分,许琛琦博士以“Sars-Cov2疫苗(中国)引起的免疫应答”为题分享了“新冠”流行当下大家十分关注的疫苗免疫反应的部分工作。提供的数据显示,经过三针疫苗注射后,机体持续产生抗体的量显著提升,而异源接种策略(两针灭活苗+一针重组病毒苗)的效果显著高于同源接种策略(三针灭活苗)。此外,他们还研究了参与疫苗免疫应答的主要细胞DC,Tfh,记忆B和浆细胞的基础代谢,发现谷氨酰胺代谢与这些生产抗体相关的细胞类型高度相关,这意味着氮源是抗体生产的关键,因此在“新冠”期间更要保证营养供给。

来自于厦门大学的张凌娟博士研究皮肤先天免疫机制,通过建立体外脂肪前体细胞诱导分化为脂肪细胞的模型,发现在脂肪细胞诱导分化的过程中,抗菌肽的表达显著上调。抗菌肽是一种天然的抗生素,它们通常带正电荷,能够高效的结合在带负电荷的微生物表面,并最终导致病原微生物的裂解。当敲除脂肪细胞中的抗菌肽相关基因,脂肪细胞便丧失了抵抗感染的功能。这也证明了脂肪组织具有抵抗病原微生物感染的作用。进一步,他们还揭示了衰老引起的皮下脂肪丢失以及其抗感染能力丧失的机制。人们通常认为脂肪组织不利于健康,但这项研究惊喜的发现脂肪组织有利于健康的一面。另外,关于脂肪组织功能的研究并不仅仅局限于代谢领域,脂肪组织越来越多的功能被挖掘,包括调节毛发生长,产热作用,纤维化瘢痕的形成以及伤口愈合等等。
12.21 Society Lecture(Las Vegas)

在拉斯维加斯会场,来自耶鲁大学医学院的林海帆教授带来了关于生殖细胞中PIWI-piRNA通路研究的报告。PIWI蛋白是PAZ-PIWI结构域 (PPD)蛋白家族的一个亚家族, piRNA(PIWI-interacting RNAs)是可以与之互作并发挥功能的一类小RNA,它们最早由林海帆教授在小鼠鉴定发现。鼠中PIWI蛋白的同源蛋白被称为MIWI(murine PIWI protein)。piRNA主要表达于生殖细胞中,种类高达16,000,000种,其序列可对应到所有类型的基因组序列,包括假基因(pseudogene),转座子(transposon),基因和非编码基因(non-coding genes)。林海帆教授团队发现,精母细胞中的MIWI蛋白对应的mRNA可被源于转座子的piRNA调控,源于假基因的piRNA可调控同源的功能基因,数以千计的长非编码RNA可被piRNA负向调控。这些研究共同说明了源自基因组不同序列的piRNA串联起调控基因组功能的网络。此外,MIWI蛋白的功能缺失会影响有丝分裂中染色体的分离,在MIWI缺失突变和slicer缺失突变的小鼠中可以观察到着丝粒和着丝粒周围的卫星转录本的过表达,而这种过表达会影响同源动粒的配对。从而影响有丝分裂中染色体的分离。而且,MIWI蛋白的缺失导致减数分裂无法完成。这项研究揭示了PIWI-piRNA可以通过调控着丝粒的功能来影响有丝分裂进程。林海帆教授的研究为我们理解PIWI-piRNA通路和全基因组功能提供了新的思路。

拉斯维加斯会场第二位报告者是来自宾夕法尼亚大学佩雷尔曼医学院的明国莉教授,她介绍了其团队对精神分裂症断裂基因1(DISC1)长达20年的追踪研究。DISC1基因最早发现自人类的精神分裂症家系,编码DISC1蛋白。明国莉教授团队发现在小鼠上抑制该基因可以影响其中枢内海马组织神经元的形态,迁移和轴突生长的靶向性,功能性突触的缺失,并在行为学层面表现出认知能力受损。进一步的,他们发现DISC1可以和钠钾氯协同转运蛋白(NKCC1)互作来调节神经发育并影响精神分裂症的发病风险,该发现在脑核磁共振实验中得到进一步确认。
此外,明国莉教授团队创新性的将源自病人的,包含DISC1截短突变的皮层神经元进行脱分化成为多能干细胞(iPSCs),来进行DISC1基因的相关研究,观察到相关神经元形态变化及功能性突触的缺失,对该突变基因进行编辑则可以逆转上述功能改变,证明针对DISC1 的相关信号通路是有效的治疗精神分裂症的靶点。在多能干细胞的基础上,其团队又建立了可以模拟人类前脑特异性的类器官,这种类器官具备特异性的表层和深层的皮层组织,并且轴突形成的模式更接近于人类大脑发育的规则和神经网络活性;在该类器官上突变DISC1,可以观察到皮层分层被打乱,解释了DISC1功能改变的中枢机制。明国莉教授团队还建立了人源化小鼠来进一步表征DISC1缺失突变在体内造成的突触和行为缺陷,并发现咯利普兰(Rolipram)这种药物可以改善上述情况。利用脑类器官系统,她的团队还系统地研究了寨卡病毒和新冠病毒暴露如何对神经系统造成影响并提供了潜在的分子机制。
明国莉教授关于DISC1的研究成果,为精神分裂症的治疗提供了新的理论依据和治疗靶点。
12.21 Society Lecture(Hangzhou)

清华大学医学院院长祁海教授介绍了关于在免疫应答过程中趋化因子如何促进高亲和力抗体产生的机制研究。B细胞可通过体细胞超突变产生高亲和力抗体,而这些具有高亲和力抗体的B细胞需要进一步地在生发中心中被正向选择保留,进而分化成记忆B细胞与长效浆细胞。在这种选择过程中,来自滤泡辅助T细胞的帮助信号非常重要。T细胞通过与B细胞的直接接触来传递可以让B细胞生存、克隆增殖的帮助信号。高亲和力的B细胞可通过细胞表面的抗体分子获取更多的抗原,进一步递呈给滤泡辅助T细胞,从而可与T细胞进行更多的互作并接受更好的帮助。T细胞和B细胞的接触受到趋化因子的调控:B细胞可通过表达趋化因子CCL22,增强与表达趋化因子受体CCR4的T细胞接触的能力。重要的是,CCL22的表达可被来源于T细胞的CD40刺激信号上调。这意味着,较高亲和力的B细胞与T细胞接触时,其中的CCL22的表达会被更大幅度的上调,从而形成正反馈,增加T细胞与这些B细胞的接触概率,使高亲和力的B细胞脱颖而出。
祁海教授的相关研究丰富了我们对抗体亲和力成熟的理解,为基于抗体的疫苗设计提供了理论支撑。

浙江大学脑科学和脑医学学院院长胡海岚教授带来了关于情绪与社会行为神经机制研究的报告。她的课题组在近年来一系列研究中发现,在抑郁小鼠中,其脑内外侧缰核(LHb)神经元表现出异常的簇状放电(bursting)模式,而通过光遗传技术在外侧缰核神经元上模拟这种簇状放电,可以诱发正常小鼠表现出抑郁样行为。进一步的,这种簇状放电是由T型钙通道(T-VSCCs)与N-甲基-D-天冬氨酸受体(NMDAR)共同介导, 阻断T型钙通道或者使用NMDA受体的阻断剂氯胺酮(Katamine),都可以起到抗抑郁的作用。她的研究还表明,一种内向整流钾离子通道Kir4.1在外侧缰核星形胶质细胞(astrocyte)上的高表达,也会导致该区域神经元发生簇状放电;特异性敲低或敲除这种钾离子通道可以缓解小鼠的抑郁表现。这些研究揭示了抑郁行为产生的新机制,为开发抗抑郁药物提供了新的靶点。
12.21 Meet the Editors

本次CBIS的Meet the Editors环节邀请到了来自Nature的编辑汪劼博士和来自Cell的编辑谭家颖博士。两位编辑首先介绍了各自旗下期刊的分类,随后通过圆桌讨论的形式,两位编辑对观众关心的投稿流程和注意事项进行了解答,强调审稿最关注文章的创新性和在相应领域的影响力。
12.21 Session 2
Neurobiology and Systems Biology

下午的神经和系统生物学专题由来自北京大学的李毓龙教授开场。他向大家介绍了实验室开发的可遗传编码的荧光探针,用于在时间和空间尺度上解析神经系统的复杂功能。与传统的方法相比,荧光成像通常具有更高的时空分辨率,比传统方法更适合测量神经递质的动态变化。首先他以催产素为例,分享了其团队研发的新型探针,能够活体监测神经肽的动态过程,并发现催产素释放不仅能在轴突释放,还可以在树突、胞体释放,且调控机制各不相同。进一步他汇报了基于荧光模块移植的策略开发新型探针,从而扩大荧光探针的种类。这些工具的开发为深入理解复杂的神经活动提供了新的窗口。

来自复旦大学的鲁伯埙教授分享了关于亨廷顿病发病机制的最新研究成果。亨廷顿病相关基因突变时会产生CAG重复序列(eCAGr, expanded CAG repeat),过去研究发现eCAGr RNA能够在体外形成聚集体并且快速变成固体。该相变过程被称为“胶体化”。但细胞内尽管也能观测到eCAGr RNA在细胞核内聚集,但却未观测到“胶体化”过程。更重要的是,该过程是否影响细胞功能,是否参与亨廷顿病等CAG重复扩增疾病的病理发展完全未知。本研究发现,细胞内的eCAGr RNA的胶体化实际发生在细胞质,但是由于细胞质内溶酶体快速降解使得其难以观察。这种胶体化形成的聚集体会捕获翻译延伸因子eEF2,从而导致细胞整体蛋白合成速率的降低,从而影响了神经功能,并进一步诱导了疾病动物的行为学表型。这项研究揭示了细胞内存在以RNA为主导的相变及其功能,为理解相关疾病的机制提供了新的角度。
12.22 Society Lecture(Las Vegas)

拉斯维加斯会场做出报告的是来自美国西南医学中心的资深科学家陈志坚教授。陈志坚教授长期从事cGAMP-STING信号通路在细胞质DNA感知和清除过程中作用以及潜在的抗肿瘤应用。今天陈教授带来了题为“DNA免疫---从人类到细菌”(DNA immunity--- from human to bacteria)的报告,分别介绍了人类细胞和细菌是如何感知细胞质的DNA分子。在细胞受到微生物入侵、发生抗肿瘤免疫反应、细胞衰老和自身免疫疾病的时候,来自外源或者自身的DNA分子可能会出现在细胞质中,这些细胞质定位的DNA分子能激活cGAS合成cGAMP。cGAMP结合内质网上膜蛋白STING,介导STING的cGAMP受体结构域相对跨膜结构域发生180˚旋转并多聚化,接着STING招募并激活下游激酶TBK1,进一步招募并磷酸化IRF3,使得其二聚化入核,开启I型干扰素的转录表达。在细菌中也有类似的机制用于对抗噬菌体。噬菌体DNA激活DncV(E.coli中的cGAS)蛋白,合成cGAMP,激活CapV,诱导细菌自杀。通过筛选变异型噬菌体鉴定到噬菌体中的Vs.4蛋白,能够结合cGAMP,使CapV不激活。细菌cGAS 通过一种新型的类似泛素化的机制增加cGAMP的产生,诱导CapV激活和细菌的自杀。
12.22 Society Lecture(Hangzhou)

细菌主要通过限制性内切酶、cGAS和CRISPR系统来对抗噬菌体。接下来来自中国科学院生物物理所的王艳丽教授就带来了题为“细菌和噬菌体之间的军备竞赛------CRISPR系统抵抗噬菌体以及Acr蛋白抑制CRSIPR功能”的报告。王教授从结构生物学和生物化学角度系统性地研究了CRISPR系统从病毒DNA获取新间隔序列与CRISPR-Cas9切割噬菌体DNA的机理,以及噬菌体编码多种Acr蛋白是如抑制细菌CRSPR系统从而逃避细菌的免疫清除。AcrIIC2阻碍Cas9-sgRNA效应复合物的组装,AcrIIC3阻止Cas9的激活,而AcrIIC5是表面带负电的蛋白,通过和DNA竞争性结合Cas9来抑制其活性。

来自厦门大学的林圣彩教授长期从事细胞代谢和能量感知的信号转导机制的研究。他领导的研究团队发现了在调节细胞代谢稳态中起中枢作用的AMPK激酶在葡萄糖水平下降的时候如何被激活的机制,及其同时抑制mTORC1的机制。其中还发现了该AMPK的激活并不依赖于AMP水平的升高,而是通过醛缩酶感知到葡萄糖代谢衍生物果糖-1,6-二磷酸(FBP)的水平下降偶联到AMPK激活的蛋白质复合体。他们通过深入的分子生物学和生物化学研究发现醛缩酶是直接感知FBP的实体,而不是感知细胞的能量下降。接下来他们又研究了调控代谢的神药二甲双胍的受体,通过合成二甲双胍的光敏感探针来寻找二甲双胍的受体分子,构建了三百多个表达载体来验证跟探针的结合蛋白质,最后通过敲低一百多个基因,最后确认PEN2是二甲双胍的受体,重要的是,该受体是通过上述的葡萄糖感知通路来激活AMPK和抑制mTORC1的。

来自深圳医学科学院的创始院长颜宁教授长期从事离子通道的结构和功能研究,在钠离子和钙离子通道蛋白领域有杰出的建树。今天她带来了题为“Targeting sodium channels for pain relief”的报告。人类有9种钠离子通道蛋白,它们分布在不同的组织器官上。和疼痛相关的钠离子通道蛋白是Nav1.7,但是由于这个蛋白家族的序列较为相似,针对Nav1.7开发的止疼药会错误作用在分布在心肌和骨骼肌细胞的Nav1.5上,导致心跳骤停等严重副作用。因此研究钠离子通道不同家族成员的结构,针对性地进行亚型特异性药物开发显得非常重要。她领导的团队通过冷冻电镜结构解析揭示了真核钠离子通道蛋白的结构和门控的调控机制。除了前期研究发现通道蛋白自身的III-IV linker可以介导快速失活(fast inactivation)的调控方式外,还进一步揭示了两种天然动物毒素——门控阻塞型多肽毒素(peptidic pore blocker)和门控修饰毒素(gate modifier toxin)对钠离子通道蛋白的抑制机制。他们的发现为深入了解相关疾病的致病机制和潜在药物特别是镇痛剂的开发提供了重要的结构基础。此外,颜教授还分享了基于脂质体整合膜蛋白的结构解析方法。
12.22 Session 2 Epigenetics and RNA Biology

2022年12月22日下午,CBIS 2022第13届双年会的最后一个专题召开,这个session的主题是表观遗传学和RNA生物学,几位教授在此分享了他们的最新研究成果,涵盖的内容既包括甲基化修饰和组蛋白组装等相对传统的表观遗传学内容,也包括新生RNA在细胞核内的分选和非编码RNA调控基因表达等新兴的RNA生物学内容。这些精彩的演讲极大地推进了我们对表观遗传学和RNA生物学的认知。
来自中科院生物物理研究所的许瑞明教授报告了对于核小体组装复合物CAF-1的结构与功能研究,揭示了其结合组蛋白的新颖模式,为理解DNA复制偶联核小体组装过程提供了重要认识。
许教授和他的团队首先用蛋白质晶体学方法解析了CAF-1复合物的核心结构,并确定和验证了CAF-1的三个亚基在CAF-1复合物中的空间位置分布和互作方式,发现大亚基p150贯穿整个复合物,其两端分别与属于WD40家族的p60和p48亚基结合,形成一个由p150连接的双结构域构象,提示了组蛋白H3-H4结合方式。随后,许教授和他的团队利用单颗粒冷冻电镜方法解析了CAF-1与组蛋白H3-H4的复合物结构,比较了CAF-1复合物结合组蛋白H3-H4前后的结构变化。揭示了核小体组装过程中的蛋白质动态结构变化,以及组蛋白H3-H4是以异源二聚体还是四聚体参与核小体组装的关键问题。为DNA复制过程中组蛋白修饰的继承机制提供了重要认识。最后,许教授还讨论了核小体组装复合物与DNA复制机器的相互作用,试图描绘核小体组装与DNA复制过程偶联的关键机制。

来自西湖大学的申恩志研究员致力于在模式动物秀丽隐杆线虫(C.elegans)中研究PIWI蛋白与piRNA信号途径的分子机制,以及它们对于抑制转座子的活动和维持生殖细胞基因组的稳定性和完整性的重要作用。
申恩志研究员和他的团队首先从target结合,target错配容忍和切割活性这三个角度分析和比较了海绵(EfPiwi),小鼠(Mili)和人类(Hili)的/piRNA复合物的差异,相比于低等的EfPiwi,Mili和Hili的seed区域匹配结合更强,随着互补区域的延伸释放target的速率明显更慢。并且,Mili和Hili对于guide和target之间的错配容忍程度更高,切割target的速率更快。为了解释这些差异,申恩志和吴建平团队解析了Mili/piRNA复合物和Hili/piRNA复合物的结构,并将它们的结构与EfPiwi的结构进行了比较和分析,相比于EfPiwi-piRISC,Mili-piRISC结合target之后,形成不同的piRNA-target duplex轨迹,更倾向于激活催化活性中心和底物切割。而EfPiwi的N959K点突变使得它的结构和生化特性更倾向于Mili和Hili。这项研究不仅为小鼠和人类中的piRNA靶向的机制提供了分子基础,更新颖地从结构和进化角度解释了高等生物和低等生物之间的PIWI蛋白的差异,以及哺乳动物是如何优化PIWI/piRNA信号途径来有效应对不断进化的转座子的。
为期四天的CBIS学术盛宴圆满落下了帷幕,在后疫情时代的当下,我们邀请到了一大批生命科学领域的顶尖科学家们,进行科学思想的交流和学术火花的碰撞,无疑是跨地域与跨时区学术交流的一次独特尝试。正如西湖大学生命科学学院院长于洪涛教授在大会闭幕时所说:“CBIS双年会已然结束,但我们仍可以看到隧道尽头的光亮!”

拉斯维加斯会场合影

杭州会场合影
最新资讯
大学新闻
人物故事
大学新闻
大学新闻
大学新闻

















