
搜索网站、位置和人员

电话: +86-(0)571-85270350 公共事务部
北京时间11月17日,西湖大学闫浈课题组与合作团队在《自然-通讯》(Nature Communications)在线发表了题为“Structure of the human sodium leak channel NALCN in complex with FAM155A”的最新研究论文,报道了一类新型人源离子通道——钠漏通道的高分辨率三维结构(图1,图2)。

图1. 论文截图
细胞内外的钠离子和钾离子浓度差导致了细胞膜两侧存在电势差,这种电势差对于兴奋性细胞的信号转导至关重要。以神经细胞为例,细胞膜两侧的静息膜电位(RMP)约为-50~-80 mV,高于钾离子的平衡电势(-92 mV)。这一去极化趋势主要由钠漏通道NALCN介导的钠离子电流来维持,这对调节神经元兴奋性非常重要。NALCN的功能异常会导致诸如精神运动发育迟缓(IHPRF),肌张力减退和发育迟缓(CLIFAHDD),婴儿神经轴索营养不良(INAD),精神分裂症和双相情感障碍等众多神经相关疾病。近年来,有多项研究报道NALCN在运动功能、疼痛敏感性和昼夜节律等许多其他基本的生理过程中也同样发挥重要作用。
图1. 人源钠漏通道NALCN结构艺术图(背景图片来自网络)
尽管NALCN在生理和病理学中十分重要,相比与之拓扑结构相近的电压门控钠离子(Nav)和钙离子(Cav)通道,其结构与功能的研究还不够深入。研究报道NALCN与多个辅助性蛋白相互作用,它们与Nav和Cav中的辅助性蛋白没有序列上的同源性,暗示了NALCN独特的调控机制。此外,对于NALCN的电压敏感性以及离子选择性等生物物理性质仍存在一定的争议。西湖大学闫浈及其合作团队结合冷冻电镜、电生理、交联质谱、分子动力模拟等技术手段对NALCN的结构与功能进行了深入研究。她们解析了人源钠漏通道NALCN与辅助性蛋白FAM155A的复合物的冷冻电镜结构,整体分辨率为3.1埃(图2)。该结构清楚揭示了NALCN与辅助蛋白FAM155A的相互作用机制。基于结构的分子动力学模拟鉴定了在NALCN独特的EEKE选择性过滤器中潜在的钠离子结合位点。同时,结构与电生理数据都支持NALCN通道活性能够受电压调控,并且辅助蛋白的结合能够影响其对电压的响应。在解析的高分辨结构当中,还意外发现了内源性脂类分子与蛋白的特异性结合,后续的突变实验进一步揭示了内源脂类分子对于该离子通道的功能具有重要调控作用。
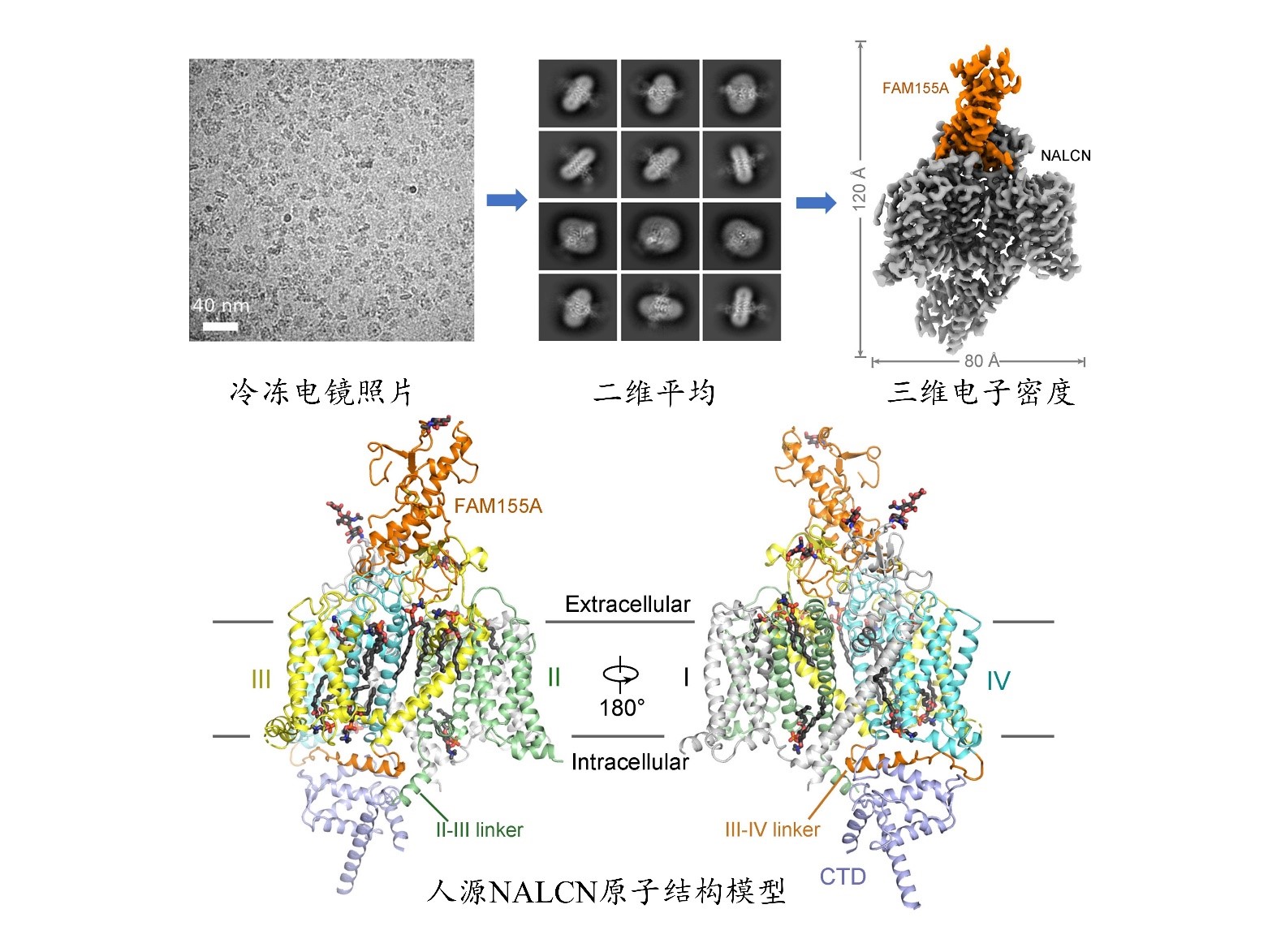
图2. 人源钠漏通道NALCN与FAM155A复合物的冷冻电镜结构
该成果深入阐释了NALCN的独特功能,揭示了其离子选择性,电压感应以及与辅助亚基的特异性相互作用的分子基础,是离子通道领域的重要进展。此外,该研究为与相关Nav / Cav通道的特性比较提供了框架,并为探索NALCN通道相关疾病的机理提供了重要线索。西湖大学闫浈,西湖大学吴建平,浙江大学杨帆为本文共同通讯作者。闫浈课题组科研助理谢炅芳,吴建平课题组博士后柯檬,杨帆课题组博士生徐丽臻为本文共同第一作者。此外,该项研究得到西湖大学冷冻电镜平台,西湖大学高性能计算平台,西湖大学质谱平台的大力支持。本工作获得了西湖教育基金会的经费支持。
闫浈课题组利用生物化学、cryo-EM、电生理、cryo-ET、crystallography等多种技术手段,聚焦于人类重大疾病相关的通道蛋白的结构与机理研究,以及植物中重要的跨膜转运蛋白的结构与功能。课题组长期招收生物化学、电生理、结构生物学、cryo-ET方向的博士后、科研助理。招收本科、硕士起点的博士研究生。同时,非常欢迎优秀的本科生前来做毕业设计。课题组将根据成员的背景和职业规划量身定制培养计划,旨在培养优秀的人才,做优秀的科研工作,欢迎加盟。
原文链接:https://www.nature.com/articles/s41467-020-19667-z
最新资讯
大学新闻
大学新闻
大学新闻

















