
搜索网站、位置和人员

电话: +86-(0)571-85270350 公共事务部
2020年11月27日,西湖大学生命科学学院施一公教授研究组就剪接体的机理与结构研究,于《科学》(Science)杂志以长文形式再次发表重大研究成果(图1)。
图1 论文截图
论文链接:
https://science.sciencemag.org/content/early/2020/11/24/science.abe8863
这篇题为《ATP水解酶/解旋酶Prp2及其激活因子Spp2催化剪接体激活过程中结构重塑的分子机理》(Mechanism of Spliceosome Remodeling by the ATPase/helicase Prp2 and its Coactivator Spp2)的论文报道了酿酒酵母处于激活状态的剪接体(activated spliceosome,定义为“Bact复合物”)2.5埃的高分辨率电镜结构,此外还解析了ATP水解酶/解旋酶Prp2处于游离状态以及Prp2与其激活因子Spp2复合物的电镜结构。该结构是目前报道的最高分辨率的剪接体结构,首次展示了剪接体状态转变过程中的“动力驱动”蛋白——ATP水解酶/解旋酶Prp2及其激活因子Spp2催化其重塑的结构基础,并结合大量生化实验,阐明了Prp2在前体信使RNA上单向移动的分子机理,回答了Spp2如何通过将Prp2锚定在剪接体上辅助其发挥重塑剪接体的功能等一系列重要科学问题。
1977年,科学家们首次发现来自于腺病毒的mRNA与其对应的DNA转录模板并不能形成连续的杂交双链,而是在杂交双链的不同位置伸出了环状的DNA单链。这个重大发现表明,遗传信息从DNA传递到mRNA上并不只是通过转录,还需要pre-mRNA剪接来进一步完成“无效”遗传信息的去除与有效遗传信息的拼接。不能被翻译的“无效”RNA片段被称为内含子,而可以被核糖体翻译的RNA片段叫做外显子,内含子被去除、外显子被连接这一过程即为RNA剪接。RNA剪接普遍存在于真核生物中,随着物种的进化,含有内含子的基因数量增加,发生RNA剪接的频率也相应增高,使得一个基因编码多个蛋白质成为可能,极大的丰富了蛋白质组的多样性,也是真核生物多样性的重要原因之一。
RNA剪接是真核生物基因表达调控的重要环节之一,其化学本质是两步转酯反应。这种看似简单的化学反应在细胞中难以自行发生,而负责执行这一化学反应的是细胞核内一个巨大且高度动态变化的分子机器——剪接体(spliceosome)。从1977年首次发现RNA剪接至本世纪初,科学家们通过免疫沉淀、基因敲除、交联质谱、建立体外剪接反应系统等研究手段,初步建立起剪接体的组装、激活与解聚的发生过程,以及蛋白与蛋白、蛋白与核酸之间的相互作用、相互调控等复杂的RNA剪接调控网络。在RNA剪接反应过程中,多种蛋白-核酸复合物及剪接因子按照高度精确的顺序发生结合、重排和解聚,依次形成预组装复合物U4/U6.U5 tri-snRNP(U4/U6.U5三小核核糖核蛋白复合物)以及至少10个状态的剪接体E、A、pre-B、B、Bact、B*、C、C*、P以及ILS复合物。剪接体每种状态的转变,都需要动力驱动蛋白——ATPase/helicase对剪接体的结构重塑进行严格的调控(图2),它们在催化剪接体构象的改变、控制RNA剪接的进程、对RNA进行检验和校对等过程中有着极其关键的作用,被誉为RNA剪接的“分子时钟”。
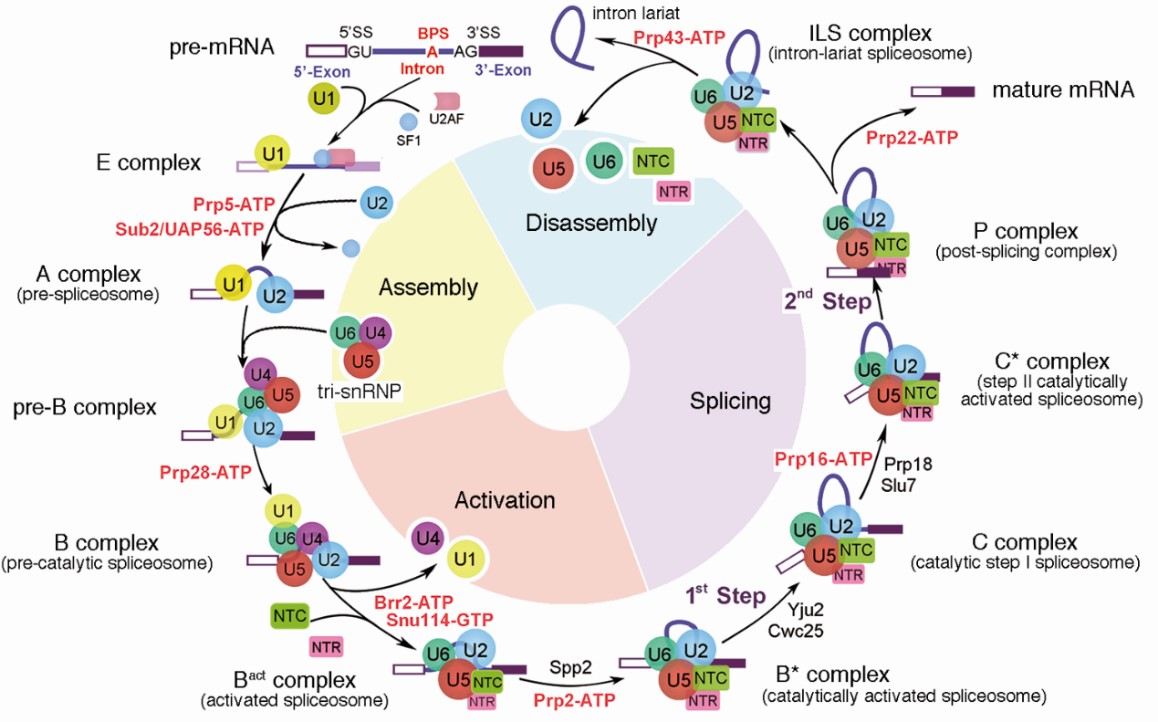
图2 RNA剪接示意图
(图片来源: Yan, C., Wan, R., & Shi, Y. (2019).
Cold Spring Harbor perspectives in biology, 11(1), a032409.)
由于剪接体高度的动态性和复杂性,获得不同状态的剪接体的高分辨率三维结构被公认为世界难题。在这种巨大的挑战下,研究组迎难而上,经过7年的努力,终于在2015年在全世界首次报道了裂殖酵母剪接体3.6埃的高分辨率结构,首次展示了剪接体催化中心近原子分辨率的结构。这一重大研究成果对RNA剪接机理的研究产生革命性影响。自2015年第一个剪接体结构发表以后,施一公研究组相继解析了酿酒酵母剪接体复合物全部已被鉴定的9个不同状态的高分辨率结构,分别是3.8埃的预组装复合物U4/U6.U5 Tri-snRNP、3.3埃-4.6埃的预催化剪接体前体pre-B complex、3.9埃的预催化剪接体B complex、3.5埃的激活状态剪接体Bact complex、2.9埃-3.8埃的催化激活剪接体B* complex、3.4埃的第一步催化反应后剪接体C complex、4.0埃的第二步催化激活剪接体C* complex、3.6埃的完成两步转酯反应后的剪接体P complex,以及3.5埃的内含子套索剪接体ILS complex的结构。这些已解析的剪接体覆盖了RNA剪接循环,从分子层面揭示了剪接体催化RNA剪接两步反应的工作机理,同时为理解剪接体的组装、激活和解聚等过程的发生提供结构依据。然而,在每种状态的剪接体结构中,“动力源”蛋白ATPase/helicase均处于剪接体的边缘,它们的构象极不稳定,因此无法揭示“分子时钟”精确的原子模型。如何阐述剪接体重塑蛋白控制剪接体状态转变的分子机理,一直是领域内的核心难题之一。
在最新发表的这篇《科学》文章中,该研究组以激活剪接体的结构重塑蛋白Prp2为切入点,巧妙地设计了Prp2的突变体,使其失去结合ATP的功能,成功的将RNA剪接阻断并富集了大量的激活状态剪接体Bact complex;失活的Prp2也更加稳定地结合在剪接体上,从而最终获得了构象稳定、性质良好的Bact complex样品。随后利用单颗粒冷冻电镜技术重构出了整体分辨率为2.5埃的Bact complex冷冻电镜结构,其中,处于剪接体边缘的结构重塑蛋白ATPase/helicase Prp2与其激活因子Spp2的分辨率高达3.2埃,并搭建了原子模型(图3)。
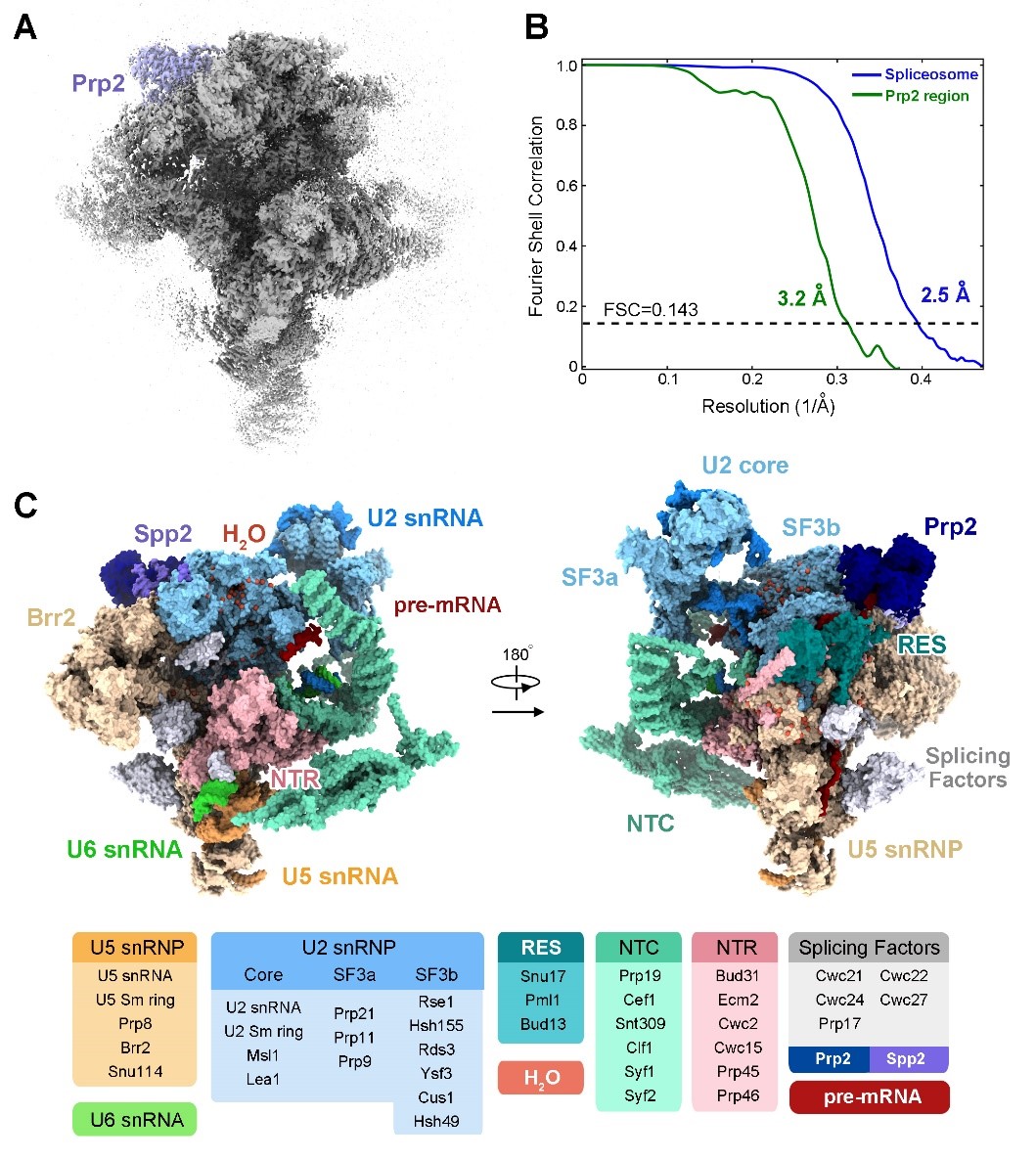
图3 酿酒酵母激活剪接体及结构重塑蛋白Prp2的三维结构
在如此高的分辨率下,该文解析的Bact complex结构首次观察到了剪接体核心区域中的水分子通过氢键参与关键剪接位点的识别、以及与金属离子的配位结合。令人惊喜的是,该结构展示了激活因子Spp2通过四个关键的锚定位点,将Prp2固定到剪接体上。Spp2对于Prp2激活剪接体、催化剪接体结构重塑的重要作用也被基于结构设计的大量生化实验验证。本文另一亮点是通过分析Prp2结合前体信使RNA的相互作用界面,并结合体外剪接反应等生化实验、以及所解析的3个不同状态的Prp2电镜结构,第一次揭示了Prp2作为ATPase/helicase在单链RNA上单向移动的分子机理。其中,两个关键的氨基酸L536和R844在阻止RNA反向滑动中起到了至关重要的作用,保证Prp2在前体信使RNA上由3’向5’方向移动,从而将分支点区域的蛋白复合物从剪接体上解离下来,促使剪接体发生结构重塑进而发生第一步剪接反应(图4)。
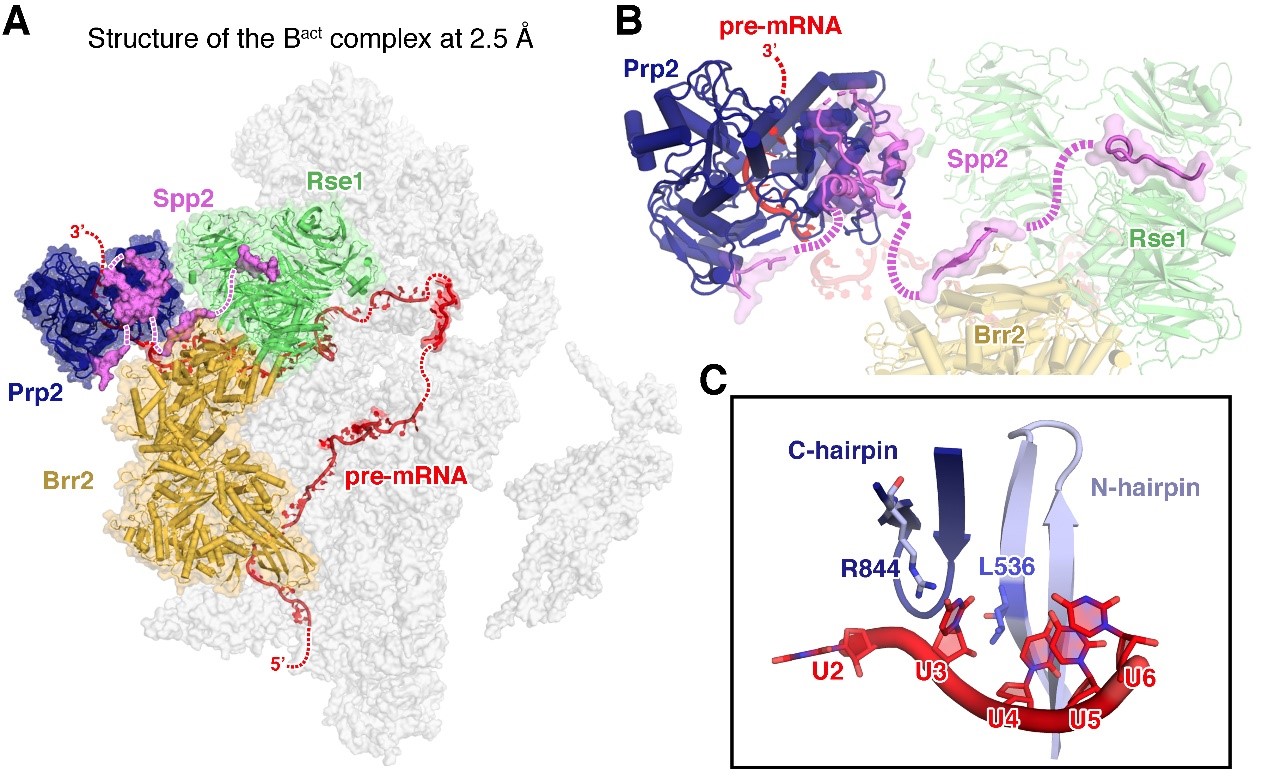
图4 结构重塑蛋白Prp2及其激活因子Spp2的三维结构
此前,研究组解析了已被鉴定的酵母中全部状态的剪接体高分辨三维结构,而本文作为第一篇剪接体重塑机制的结构研究,首次揭示了位于剪接体原位的ATPase/helicase高分辨率的三维结构,为理解剪接体激活重塑的分子机理提供了迄今最清晰的结构信息。
西湖大学生命科学学院施一公教授、西湖大学生命科学学院西湖学者万蕊雪博士为本文的共同通讯作者;西湖大学生命科学学博士后白蕊、西湖学者万蕊雪和清华大学生命科学学院助理教授闫创业为该文的共同第一作者,清华大学生命学院博士生贾麒参与了部分生化实验;清华大学冷冻电镜平台主管雷建林博士为冷冻电镜数据收集提供了帮助。电镜数据采集于清华大学冷冻电镜平台,计算工作得到清华大学高性能计算平台、国家蛋白质设施实验技术中心(北京)的支持。本工作获得了西湖教育基金费、北京结构生物学高精尖创新中心(清华)及国家自然科学基金委的经费支持。
相关论文链接:
http://science.sciencemag.org/content/early/2016/01/06/science.aad6466
http://science.sciencemag.org/content/early/2015/08/19/science.aac8159
http://science.sciencemag.org/content/early/2015/08/19/science.aac7629
http://science.sciencemag.org/content/early/2016/07/20/science.aag0291
http://science.sciencemag.org/content/early/2016/07/20/science.aag2235
http://science.sciencemag.org/content/early/2016/12/14/science.aak9979.full
http://www.cell.com/cell/fulltext/S0092-8674(17)30954-6
http://www.cell.com/cell/fulltext/S0092-8674(17)31264-3
http://science.sciencemag.org/content/early/2018/05/23/science.aau0325
https://www.cell.com/cell/fulltext/S0092-8674(19)30155-2
最新资讯
大学新闻
大学新闻
大学新闻

















