
搜索网站、位置和人员

电话: +86-(0)571-86886861 公共事务部
艰难梭菌是造成医院和社区内肠道感染主要的病原菌之一,会引发包括腹泻、伪膜性结肠炎、脓毒症在内的一系列病症,严重时可危及生命1。艰难梭菌分泌的外毒素B(TcdB)被认为是引发疾病的最关键致病因子,先前研究发现临床分离的艰难梭菌流行性菌株中的TcdB存在多个变种(亚型),其中1、2、3、4型是临床常见的亚型2。
近日,西湖大学生命科学学院的陶亮研究员以通讯作者在微生物学著名期刊PLOS Pathogens上发表了题为“Functional analyses of epidemic Clostridioides difficile toxin B variants reveal their divergence in utilizing receptors and inducing pathology”的研究论文。该工作分析了艰难梭菌临床流行菌株中TcdB不同变种的受体选择特异性,揭示了流行菌株中的TcdB主要亚型对已知的宿主受体硫酸软骨素蛋白聚糖4(CSPG4)和卷曲受体(FZD)蛋白有着截然不同的识别倾向。小鼠模型进一步显示1、2、3、4型TcdB诱导产生的肠道上皮病理均存在显著区别,并证明其病理差异是由于毒素识别不同受体导致的。此外,研究还发现了TcdB蛋白同时通过多个结构区域结合其受体CSPG4,从分子水平揭示了一种新的毒素-受体的识别方式。本工作对理解艰难梭菌流行性菌株中毒素变体的毒理学和病理学有着重要意义,并有助于指导艰难梭菌感染临床检测和治疗。
西湖大学生命科学学院陶亮课题组的科研助理潘振瑞、张媛媛和博士后罗建华为本文的共同第一作者,波士顿儿童医院/哈佛医学院的董民教授和西湖大学生命科学学院的陶亮研究员为共同通讯作者。
论文链接:https://journals.plos.org/plospathogens/article?id=10.1371/journal.ppat.1009197

病原体的变种的产生往往伴随着致病性的改变,研究病原体各亚型的区别对于认识病原体感染的病理和流行规律,进而指导疾病的预防、诊断和治疗有着极为重要的意义。艰难梭菌TcdB原型(1型)主要利用CSPG4和FZD蛋白作为其最重要的宿主受体3,4。陶亮课题组先前的研究报道了除原型的TcdB外,临床分离的艰难梭菌致病菌株中还表达有多个TcdB变种,其中2、3、4型是较常见的毒素亚型2。
在本项研究中,研究者首先利用了一组包含了野生型、CSPG4敲除和FZD敲除的细胞系作为细胞研究系统,综合分析了1-4型TcdB对CSPG4和FZD蛋白的受体识别特异性。实验结果显示不同亚型的TcdB对于已知受体有着截然不同的选择倾向:其中1型TcdB同时使用CSPG4和FZD作为细胞受体,2型TcdB专一识别CSPG4,3型TcdB主要利用FZD作为受体,而4型TcdB几乎不使用CSPG4和FZD蛋白作为受体,很可能是使用一种全新未知蛋白作为细胞受体(图1)。
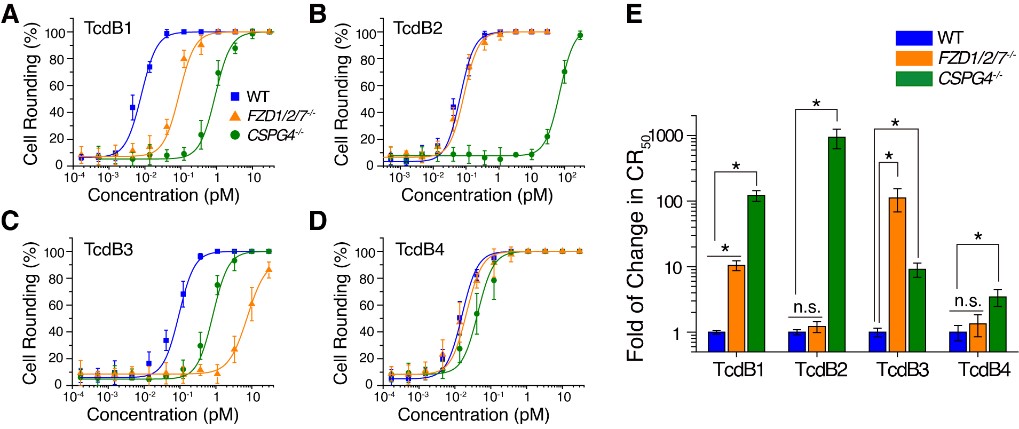
图1:艰难梭菌毒素B各亚型对CSPG4和FZD蛋白作为受体显示出截然不同的选择倾向。
对比TcdB与受体FZD互作的分子机制已经明了5,TcdB与其受体CSPG4的分子作用机制却一直不清楚,唯一的前期共识是TcdB分子序列1830位附近的区域影响了和CSPG4的相互结合。本研究显示1型和3型TcdB对CSPG4的亲和性存在着显著差异,而两者位于1830位附近区域的蛋白序列几乎是一致的,主要的差异存在于N端的约800个氨基酸中。基于该发现研究者进行了详细的序列比较从而设计了一系列的突变体,并鉴定到包括624、626等在内的多个氨基酸位点可以影响TcdB和CSPG4的相互结合(图2)。

图2:基于1型和3型TcdB序列分析设计的一系列突变体鉴别到位于TcdB N端的数个氨基酸位点可以影响对CSPG4的识别。
结合先前探明的影响TcdB和CSPG4相互作用的1824、1839等氨基酸位点6,和最新解析的全长TcdB的晶体结构等知识7,研究者推断出TcdB和CSPG4的互作涉及了TcdB分子中多个一级序列上相互离散而空间结构上相互靠近的结构域(图3)。这是一种全新的毒素-受体相互作用的分子机制,同时为开发抑制TcdB和其受体CSPG4结合的靶向分子药物提供了理论基础。
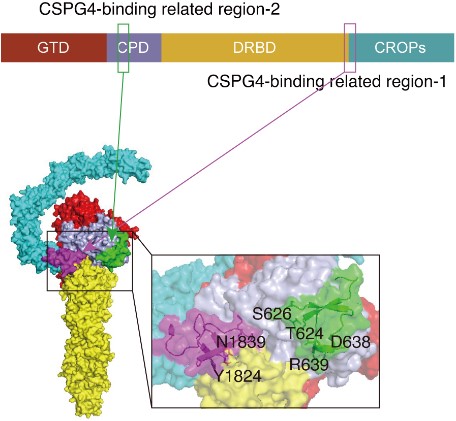
图3:TcdB和CSPG4的互作涉及了TcdB分子中多个一级序列上相互离散而空间结构上相互靠近的结构域。
接下来研究者建立了一种小鼠直肠灌注模型,来具体研究不同亚型的TcdB在导致肠道病理发生上的区别。结果显示在相同剂量下,1型TcdB对小鼠肠道上皮造成的病理损伤最为严重,其次为2型和3型TcdB。有趣的是,尽管2型和3型TcdB诱导的病理损伤总体评分相近,其相对应的病理特性却大相径庭。2型TcdB引发了重度的肠道黏膜水肿,而免疫细胞浸润较少;而3型TcdB仅造成中度的肠道黏膜水肿,却引发了极为严重的炎症细胞浸润(图4)。联系到2型和3型TcdB偏向使用不同的宿主受体,研究者推测该病理差异是由于毒素的受体选择特异性造成的。为了验证该猜测,研究者构建了嵌合毒素来切换其受体选择性并进行进一步的病理学研究,实验结果同样支持了受体差异是导致病理差异的这一结论。
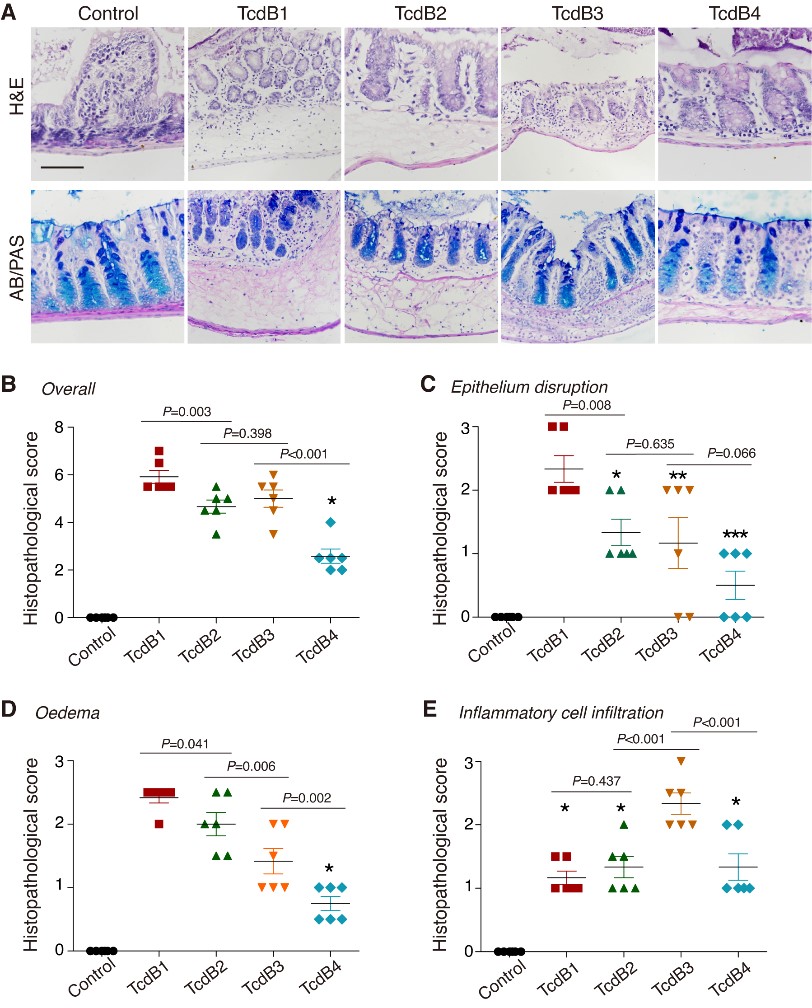
图3:小鼠肠道模型显示4种常见的TcdB亚型可以诱导显著差异的病理表征。
总结来说,该研究揭示了临床流行的艰难梭菌毒素B亚型存在着明显的受体识别差异性,并在小鼠模型上导致了不同的肠道病理特征。包含不同TcdB亚型的艰难梭菌在感染者中可能会引发不同的病理进程,这一点尤其值得引起临床诊断和治疗的关注,同时有待临床和实验的进一步研究和证实。区分和鉴定TcdB亚型在治疗艰难梭菌感染时可能成为一个推荐选择,同时有助于临床艰难梭菌感染的治疗方法的开发。4型TcdB在小鼠肠道模型中引发的病理表征较弱,然而细胞实验显示毒性却很强,临床病例也报道了分泌4型TcdB的艰难梭菌可引发重症感染。4型TcdB几乎不使用FZD和CSPG4作为细胞受体,其宿主受体和生理上的靶向组织还有待进一步的研究探索。
西湖大学陶亮课题组同时受到西湖实验室和浙江省结构生物学研究重点实验室的支持。实验室主要从事病原微生物和宿主之间的相互作用的研究,包括从分子、生化、细胞、结构、组学等方面研究病原体及其效应蛋白对重要细胞功能的影响及作用机制,并针对细菌效应蛋白开展相应的工程开发研究。实验室招收分子生物学、细胞生物学、微生物学、生化和结构生物学、生物信息学、遗传和实验动物学等方向的科研助理、助理研究员和博士后,热忱欢迎加盟。简历和相关材料请投递至:taoliang@westlake.edu.cn。
参考文献
1. Lessa, F. C.et al.Burden of Clostridium difficileinfection in the United States. N Engl J Med372, 825-834, (2015).
2. Shen, E. et al.Subtyping analysis reveals new variants and accelerated evolution ofClostridioides difficiletoxin B. Commun Biol3, 347, (2020).
3. Yuan, P. et al. Chondroitin sulfate proteoglycan 4 functions as the cellular receptor forClostridium difficiletoxin B. Cell Res25, 157-168, (2015)
4. Tao, L. et al.Frizzled proteins are colonic epithelial receptors for C. difficiletoxin B. Nature538, 350-355, (2016)
5. Chen, P. et al. Structural basis for recognition of frizzled proteins by Clostridium difficiletoxin B. Science360, 664-669, (2018)
6. Gupta, P. et al. Functional defects in Clostridium difficile TcdB toxin uptake identify CSPG4 receptor-binding determinants. J Biol Chem292, 17290-17301, (2017)
7. Chen, P. et al. Structure of the full-length Clostridium difficiletoxin B. Nat Struct Mol Biol26, 712-719, (2019)
最新资讯
学术研究
学术研究
学术研究
大学新闻

















