
搜索网站、位置和人员

电话: +86-(0)571-86886861 公共事务部
当我们望向一面镜子,将能得到什么?
唐代官员、诗人李益看到了当下的自己,感慨道:一别青春鉴,回光照华发。
《白雪公主》里的继母皇后,向镜子要一个答案:谁是世界上最美的女人?
同在童话里的爱丽丝,直接掉入了镜中的世界,发现那里一切都是颠倒的……
而当“镜子”到了科学家手中,他们利用它,又解决了一个现实世界的难题——
近日,西湖实验室,西湖大学未来产业研究中心、生命科学学院卢培龙团队与清华大学刘磊团队合作在Cell Research杂志发表了题为“Accurate de novo design of heterochiral protein-protein interactions”的研究论文。该研究成功建立了镜像蛋白的从头设计和定向进化体系,实现了针对靶蛋白特定结构表位精确设计镜像结合蛋白。
通俗地讲,他们开发了一种创新的"镜像设计",能够针对天然存在的蛋白质,设计出能与之结合的镜像蛋白质。

要明白这个研究,我们可以伸出自己的双手。
双手摊开、掌心向上,它们像一对在镜子两侧的“孪生兄弟”;掌心相对时,它们可以完美贴合;但它们事实上在空间上又无法完全重叠。这样两者互为镜像的形态,在科学界被称之为手性。许多有机分子都能以左手性和右手性的形式存在,称作L型(左手性)和D型(右手性)。
但大自然有自己的“偏好”。所有你听闻过的、存在于大自然中的千千万万种蛋白质,都是L型蛋白质。这是因为它们由L-型的氨基酸形成链条后折叠而成,因此无论是哪种蛋白质,在空间形态上拥有着一致的手性。
人体中的蛋白质也遵循着这样的规律,也就是说,我们身体内的蛋白质均为L型蛋白。正因如此,有一部分科学家也关注到了L型蛋白(左手性)“镜中”的对映体,即D型蛋白质(右手性),由D-氨基酸构成。
恰恰是由于在人体中不存在,D型蛋白被应用于在药物上,就表现出了独特的优势:免疫原性低——由于免疫系统一般无法识别D型蛋白,因此极少产生抗体和免疫反应;口服给药、长效治疗潜力大——人体内的蛋白酶只能处理L型蛋白,无法对D型蛋白进行降解,这意味着药物的稳定性好,既能口服,也能长期发挥作用。这一类非传统新型蛋白质多肽药物,即“镜像蛋白质多肽药物”,拥有着巨大潜力。
在这类药物的开发中,如何精准设计镜像蛋白质(即D型蛋白),使其与天然蛋白质(L型蛋白)特定结构表位形成高亲和力的相互作用(或者说“结合”),是镜像蛋白多肽药物研发的关键之一。
古希腊亚里士多德感慨说,大自然的每一个领域都是美妙绝伦的。看起来只需要效法自然,做出一些能够与“左手”蛋白质“握住”的“右手”蛋白质,但科学届之前没有成功的、直接针对L型蛋白精确设计D型结合蛋白的先例,这是由于自然界中不存在D型蛋白,人们不清楚D型蛋白与L型蛋白相互作用的奥秘。
同时,逐个测试设计的D型蛋白,费时费力。这就要求科学家们构建一个高通量、“批量化”的测试体系来测试设计的D型蛋白与L型蛋白之间的相互作用。然而,这种高通量的测试体系需要将蛋白表达在酵母表面,对D型蛋白来说,没有办法在酵母中表达;但倘若是L型蛋白,就可以高通量地完成测试。
此时,卢培龙实验室想到了“镜像表面展示体系”。在之前领域内的研究中,已经开发了这种高通量的筛选体系,但直接使用这种办法,筛选性价比低,也难以结合到靶蛋白的特定表面区域。不过不要紧,此刻,它为这个研究团队,提供了一个完美的测试体系,帮助卢培龙实验室与合作者在本研究中建立了“镜像设计”方法:
第一步,通过镜像翻转L型靶蛋白,获取D型靶蛋白。
第二步,针对D型靶蛋白的特定结构表位进行分子对接和相互作用界面设计,以设计出大量潜在的能与D型靶蛋白有效结合的L型结合蛋白。所谓“针对特定结构表位”,指的是我们可以针对性选择L型靶蛋白上药物需要结合的点位,找到“镜像”中对应的位置,来展开设计。
接下来,由此构建L型结合蛋白质文库,并利用酵母展示技术进行高通量测试表征,鉴定出能与D型靶蛋白结合的L型结合蛋白序列。也就是说,通过电脑计算,设计出一批有望与“镜中蛋白”结合的L型蛋白质,再通过酵母这一载体,高通量地表达出设计好的蛋白,并鉴定出哪些确实能结合。
第三步,采用化学合成方法制备出和这些L型蛋白具有相同序列、但手性相反的D型结合蛋白,即对L型结合蛋白进行“镜像反转”,并对“成品”进行结构和功能分析。
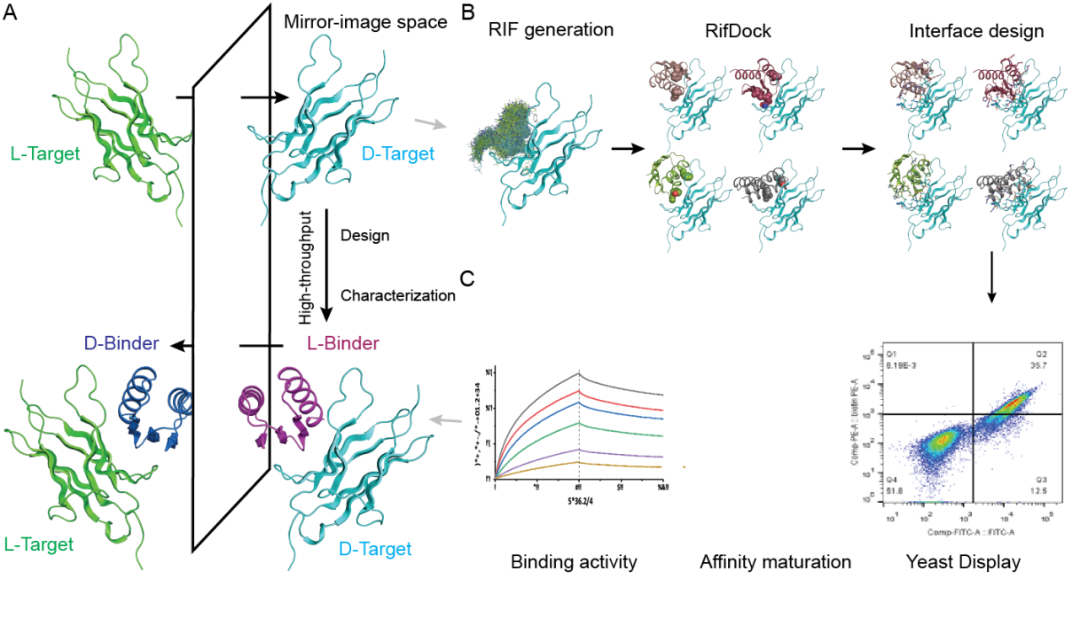
图1 镜像结合蛋白的从头设计和定向进化体系
为了验证这个新颖的镜像结合蛋白从头设计体系,这支研究团队选取了三种靶蛋白进行设计,包含人工设计的α螺旋短肽、神经生长因子(NGF)的受体原肌球蛋白受体激酶A(TrkA)、以及白细胞介素6(IL-6)。第一种是人工设计的L型蛋白质,后两种则分别与癌症、痛觉和诸如细胞因子风暴、风湿病等免疫疾病相关。
他们成功设计、筛选并合成了具有高亲和力和高特异性的D-蛋白结合分子。具体结果表明,D型结合蛋白的二级结构与设计模型一致,并展现出与L型结合蛋白的镜像关系。这些蛋白具有出色的热稳定性,即使在95摄氏度时也能保持完整的二级结构。亲和力测定表明,D型结合蛋白与相应的L型靶蛋白的结合力强,亲和力范围约在20至150 nM之间,与L型结合蛋白相当;这是一个相当理想的数值,意味着确实设计出了能够结合目标蛋白的镜像结合蛋白。
蛋白酶降解实验显示,D型结合蛋白具有出色的抗蛋白酶降解特性。这意味着这些蛋白有可能延长在人体中存在的时间,为未来的口服给药和长效治疗提供了理论基础。
进一步,卢培龙实验室和合作者一起合成了“更强”的D型结合蛋白。他们对蛋白进行定向进化,即通过突变生成可能的“更优解”,获得了亲和力增强至皮摩尔的变体,相当于把结合能力提升了十到五十倍。同时,他们对这些“升级版”D型结合蛋白,在细胞层面的功能表现进行了评估,结果显示这些蛋白具备潜在的成药性(即有望被用于药物中)。
此外,在结构方面,研究人员也解析了D型结合蛋白与目标蛋白(人工设计的L型α螺旋短肽)的复合物的晶体结构,解析分辨率为2.0 Å(图2)。结构分析显示,晶体结构与设计模型的主链碳原子RMSD仅为0.6 Å,且相互作用界面上的氨基酸构象与设计模型高度一致。这些数据,说明了这项“从头设计”的方法所产生的蛋白质与设计极为接近,具有极高的精确度。这是世界上首次精确设计了D型结合蛋白与L型目标蛋白的之间的相互作用。同时,这一晶体结构也揭示了左手性α螺旋与右手性α螺旋相互作用的机制,它们在结构中完美地结合到一起,就像传动机械装置中的两个相互耦连的齿轮一样,旋转的方向相反。
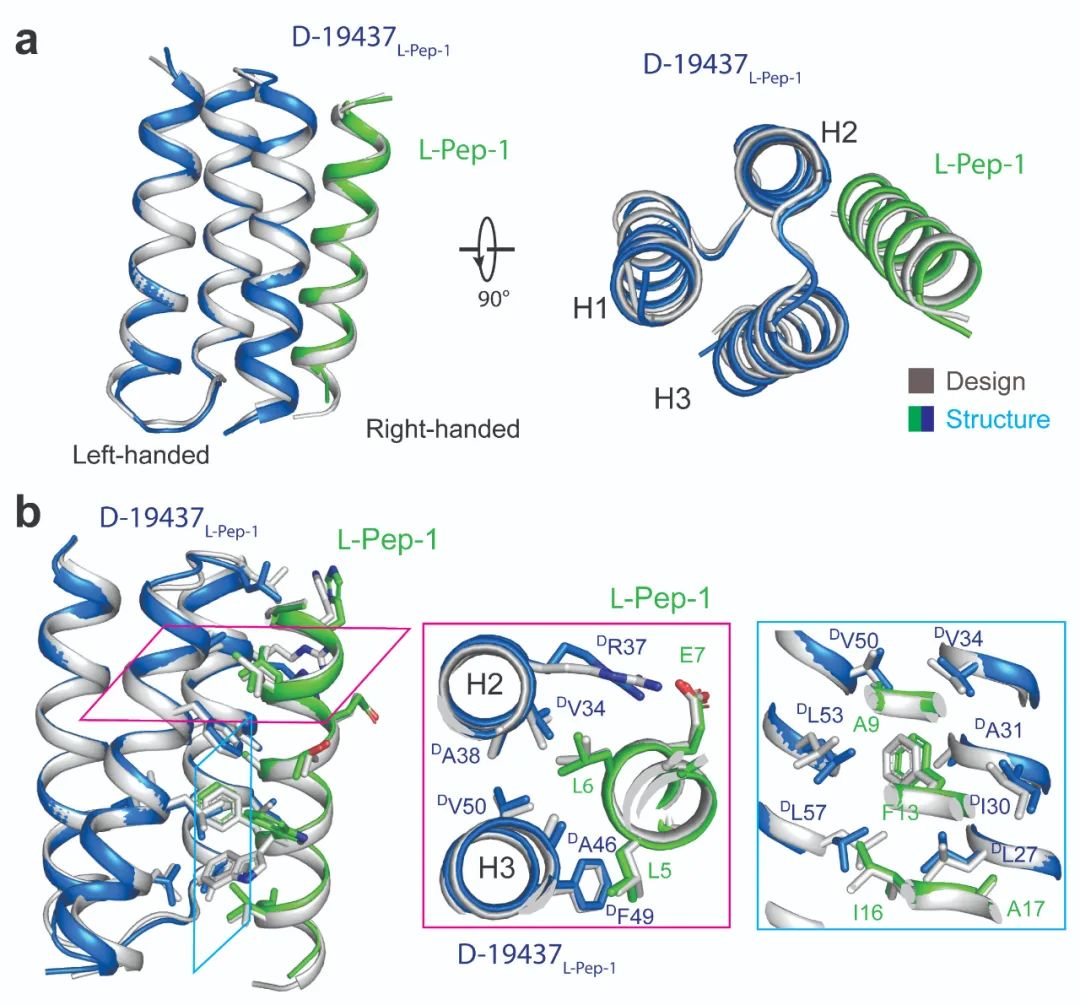
图2 D型结合蛋白与L型α螺旋短肽复合物的晶体结构
“我有一面镜,新磨似秋月”,镜中的世界,终于不仅仅是镜花水月,而为现实照耀出了更广阔的天地。
这项研究成功开创了针对特定空间结构表位的镜像结合蛋白精确从头设计,并在结构、生化、细胞等多个维度上验证了功能,为镜像蛋白多肽药物的开发奠定了坚实的基础,也为镜像生物学提供了全新的研究工具。
这是卢培龙实验室在镜像蛋白质方向取得的第一个成果。
科学前进的步伐,有时正是源自科学家们一些些的敢想,和一点点的专业直觉与确信。回溯整个研究历程,最具有挑战的,还是构思这个“镜像设计”的方法。“最一开始的时候我们也不知道能不能成功,毕竟在自然界中完全不存在这样的镜像蛋白质。不同手性间的蛋白质的相互作用,理论上应该能遵循同样的物理规律,我们尽可能做到形状互补、化学性质互补,以提升蛋白间的亲和力。”卢培龙回忆道。
接力这套新鲜出炉的“镜像设计”,接下来,卢培龙实验室将再往“镜中世界”的深处走一走。比如:既然天然蛋白能结合“镜像世界”的蛋白,那么天然蛋白能不能催化“镜像世界”里的反应?在前景广阔的口服药物市场中,镜像蛋白质药物又能如何发挥所长?
“我们将进一步构建天然世界和镜像世界之间的联系。”卢培龙总结说。
未来,手中一面“镜”还将给生物学家、给科学家、给全人类,映照出哪些惊喜呢?
西湖实验室,西湖大学未来产业研究中心、生命科学学院卢培龙研究员和清华大学化学系刘磊教授为共同通讯作者。西湖大学生命科学学院博士研究生孙科、博士后李思聪、博士后郑博闻、博士后朱雁磊以及清华大学化学系博士研究生王通越为本文的共同第一作者。本研究得到科技部、国家自然科学基金、西湖实验室、中国博士后科学基金等资助;同时得到了西湖大学未来产业研究中心、高性能计算中心、质谱与代谢平台、晶体学平台的大力支持。
最新资讯
人物故事
大学新闻
大学新闻
大学新闻
学术研究

















