
搜索网站、位置和人员

电话: +86-(0)571-86886861 公共事务部
“很遗憾地告诉您,病人的癌细胞已经扩散到了其他器官。”
影视剧中,每当医生说出这样的台词,我们常常会心头一紧,为片中人物的命运担忧。伴随着科技进步与疾病治疗水平的提高,虽然大家不再会轻易“谈癌色变”,但“癌细胞扩散”、“肿瘤转移”等字样依然代表着病情已经进入最凶险的阶段。
北京时间11月25日晚24点,西湖大学/西湖实验室邹贻龙课题组和王曦课题组在《细胞》(Cell)杂志发表文章,系统性地解析了支撑卵巢癌远端转移的代谢基础,并深入揭示不饱和脂质在肿瘤转移的各个阶段起到的多重作用(图1)。换句话说,他们找到了与卵巢癌转移过程相关的关键脂质代谢通路与基因。
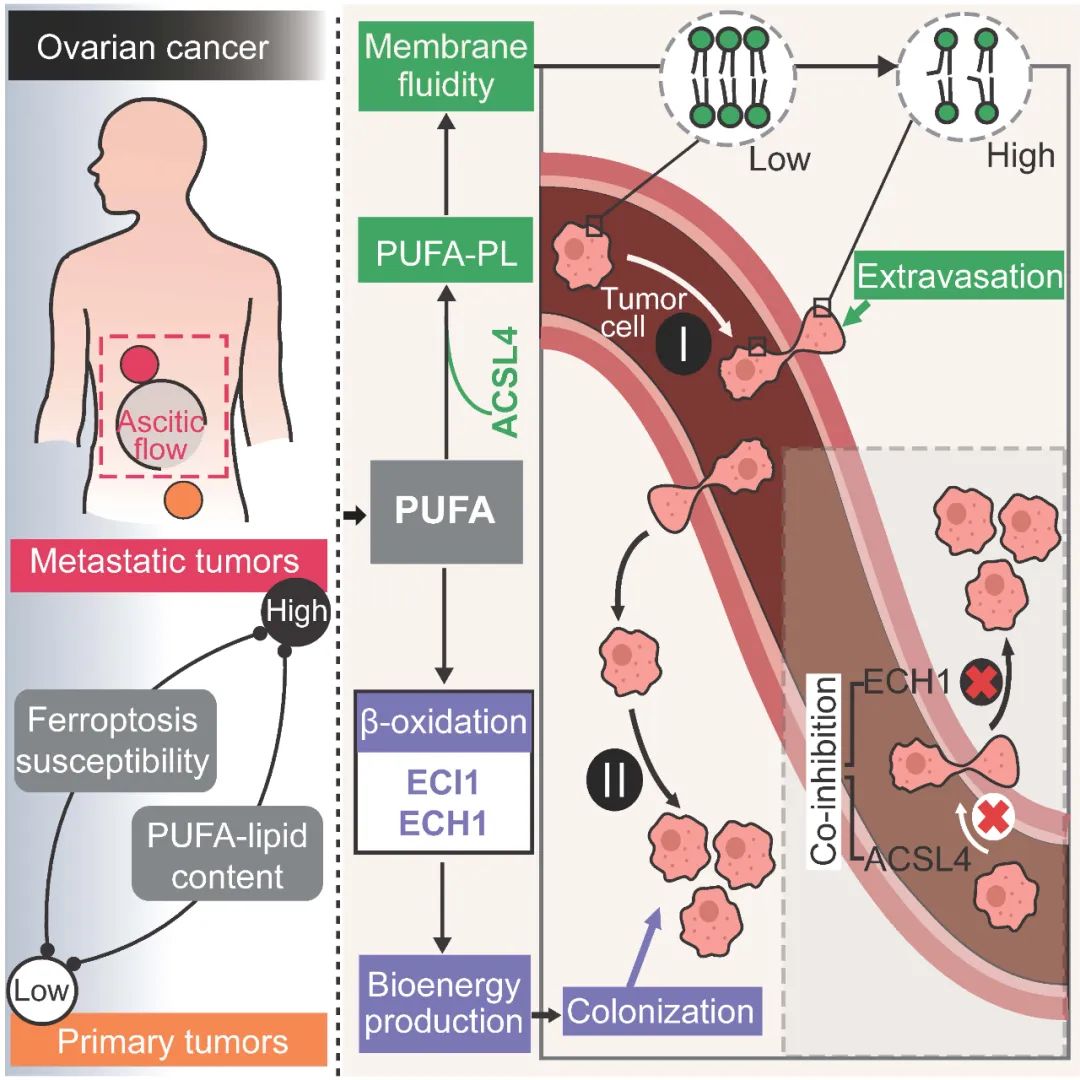
这为肿瘤机制的研究提供了及时的资源与模型,为抗肿瘤转移的治疗提供了潜在的药物靶点。更重要的是,由于该机理适用于多种癌症,这些发现将能帮助人们更透彻理解肿瘤转移的代谢调控机制,开发针对包括卵巢癌在内的多种癌症的转移药物。

论文截图
原文链接:https://www.cell.com/cell/fulltext/S0092-8674(24)01270-4
癌细胞为什么会“远足”?一切要从癌症如何发生讲起。
想象我们的身体是一座大花园,每一颗细胞就像是生长在其中的一株植物。在正常情况下,所有植株按照规律成长,花园生机盎然、井然有序。但某天,一些植株突然疯狂生长,并逐渐向外蔓延……这些异常的“植株”就是癌细胞,这个过程对应着癌细胞异常增殖和扩散,形成的肿块称为肿瘤。更疯狂的是,如果无法阻止这个过程,这些植株还会脱离原来的生长地点,侵袭花园里的其他空间,并在新的位置重新扎根。这个过程即癌细胞的“远足”,也就是肿瘤转移。
事实上,癌症的早晚期之分,正与肿瘤转移的程度密切相关。早期,指的是癌细胞仍然在原来的位置,一般通过手术切除肿瘤,病人就能痊愈;而到了晚期,癌细胞已转移到淋巴结及其他器官,甚至扩散到全身,就是晚期中最为严重的情形。因此,肿瘤转移是癌症治疗中的焦点问题。
邹贻龙和王曦团队选定以卵巢癌为例,来探寻肿瘤转移的过程。临床数据显示,70%以上的患者在被诊断为卵巢癌时,癌细胞已经发生了多位点转移——显然,这是一个转移易发生、转移速度快、传播脏器范围广的癌种。更令人头疼的是,该癌种的远端侵袭至少存在三种不同的转移路径:腹水转移(通过腹腔液体传播)、血运转移(通过血液传播)和淋巴转移(通过淋巴系统传播)(图2)。
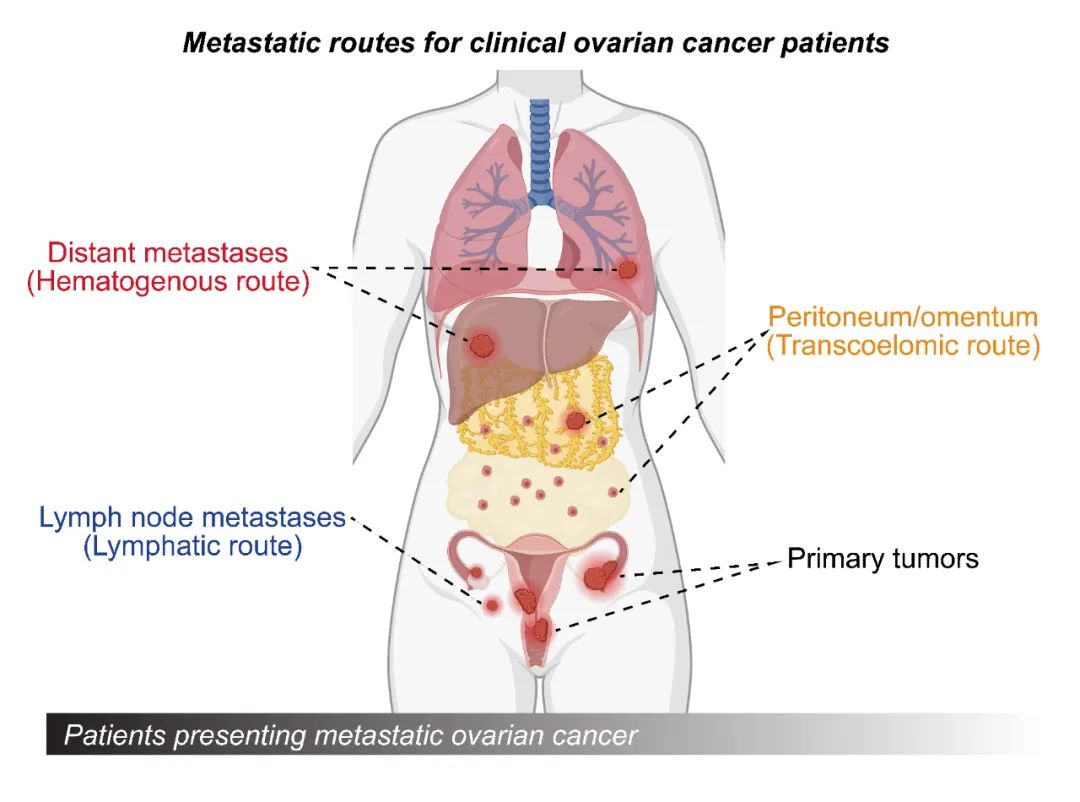
图2. 临床上卵巢癌患者中肿瘤实现远端转移的三种主要扩散路径。
正是因为转移方式“多管齐下”,卵巢癌的有效治疗相当棘手,病情也极易反复。目前针对卵巢癌转移的研究大部分聚焦于腹腔内部的转移,对于那些真正的“远行”至腹腔外重要脏器的转移,比如肺转移,相关成果少之又少。
02
关注西湖的读者或许曾在我们的微信公众号上读过一则新闻:因肿瘤代谢与细胞死亡机制的研究,西湖大学邹贻龙入选《麻省理工科技评论》“35岁以下35人”2022年中国榜单。(阅读原文:比35岁更重要的是 ______?)
邹贻龙,2005-2009年就读于清华大学生命科学与技术系,2016年获得美国纪念斯隆凯特琳癌症中心癌症生物学博士学位,之后在波士顿博德研究所以及哈佛大学化学生物学系从事博士后研究,2020年加入西湖,担任功能脂质组学与代谢调控实验室负责人。
全世界关注癌症的学者很多,但邹贻龙的“赛道”很独特,他聚焦于肿瘤和脂类的关系,探寻在肿瘤发生、发展过程中,作为细胞基本组成成分的脂类,在扮演怎样的角色。
脂类是细胞最基本的组成成分,也是界定生命体与非生命体的最关键因素之一。人体内的脂类有逾万种,我们耳熟能详的脂肪酸、甘油三酯、胆固醇都是其中的重要分子。它们在生物体中扮演着多种重要角色,包括能量储存、细胞膜的构成、代谢调节等等。
这一次的突破之旅,邹贻龙团队就从他们最熟悉的“面孔”脂类入手。他们想知道,在卵巢癌细胞转移过程中,这些细胞中的脂类在“干什么”?脂类代谢中的哪些步骤是癌细胞要完成“远足”必不可少的?
王曦,本科毕业于清华大学,博士毕业于康奈尔大学,2021年加入西湖,担任西湖基因组学与生物信息学核心实验室负责人,在肿瘤基因组学与生物信息学大数据方面有着深厚的经验和研究基础。
邹贻龙课题组决定先通过大数据,找出那些“特别擅长远足”(即高转移能力)的癌细胞的弱点。通过与王曦团队合作,他们发现,肿瘤细胞的转移能力可能与多种化合物的敏感性相关。一些化合物的存在会不利于癌细胞生存,而其中的“佼佼者”,恰好与细胞铁死亡过程有关。
铁死亡也是邹贻龙实验室重点关注的现象之一,它指向一种由高度不饱和磷脂的过氧化修饰的过量聚集引起的细胞应激性死亡途径。简单说,就是脂质过度氧化,像我们生活里使用的铁制品生锈了,而细胞的“铁锈”更可怕之处在于其会在生物膜上快速传播,当这种被氧化破坏的脂质达到致死水平,就会引发细胞不可逆死亡。
团队发现,GPX4蛋白与SLC7A11蛋白,原本能够保护细胞免受铁死亡侵扰,但如果加入GPX4蛋白的抑制剂ML210、RSL3、ML162,或SLC7A11蛋白的抑制剂Erastin,这两个蛋白就无法再发挥对细胞的“保护”作用。
从卵巢癌患者体内分离的原代细胞(即从人体中直接分离并在体外培养的细胞,保留了在患者体内原始的基因状态)证实了这一点。那些使细胞更容易出现铁死亡的化合物,却也能让癌细胞“瑟瑟发抖”不敢“出走”。
对转移癌细胞脂质成分的分析,也从另一个角度验证了这一结论(近年来质谱技术的突飞猛进首次让大规模分析细胞脂质成为可能)。脂质组学分析清晰揭示了擅长“远足”癌细胞的特点:它们含有更高水平的多不饱和脂质。我们可以理解为,癌细胞需要更强的能量动力才能跑更远,就像人储存的脂肪到需要的时候可以分解产生能量。而这类脂质恰恰也是铁死亡得以发生的主要底物,它们在为癌细胞提供能量的同时,也导致这些细胞更容易发生铁死亡。
“成也萧何,败也萧何”。这意味着,肿瘤细胞的脂质组成可能具有直接调控其转移的能力,从理论上提供了一种靶向诱导癌细胞死亡的新思路(图3)。
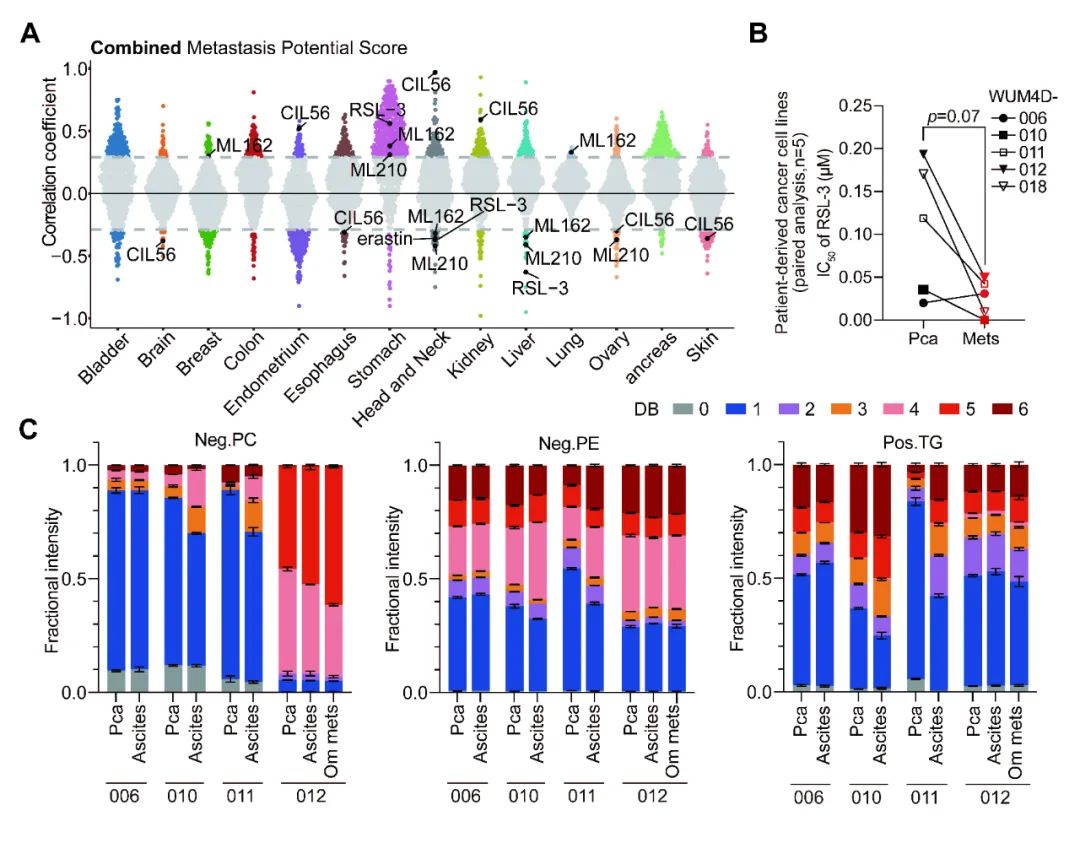
图3. (A)散点图展示了按谱系分组的MetMap癌症细胞系转移能力与CTRPv2化合物敏感性之间的相关性。(B) 散点图展示了来自配对的卵巢癌患者原发瘤,腹水,大网膜转移瘤来源的原代细胞对RSL-3化合物的IC50值。(C) 堆叠条形图展示了原代肿瘤细胞脂质组学分析中各脂质类别内特异性脂质的相对强度。脂质按照脂肪酰侧链中的最大不饱和度进行分组。
癌症转移发生的过程极其复杂,想要进一步揭示脂质组成和代谢因素对卵巢癌转移的调控作用,必须找到并建立高效的癌症转移动物模型——让实验动物表现出与人类疾病相似的病理特征——这是最难的一步,也正是目前关于卵巢癌远端转移的研究中所匮乏的。
研究人员锁定了一株同时具有极高转移能力和铁死亡敏感性的人卵巢癌细胞系ES-2,并对它进行了多轮体内筛选——你可以理解为对细胞系“成员”在生物体内并进行“实战海选”——找到那些转移能力强、并具有多路径转移潜能的癌细胞,再对这些细胞进行克隆,培养“强中更强”的理想模型。最终,他们获得了强转移能力的亚细胞系ES-2-MC2-Lung和ES-2-MC2-Hep。看似信手拈来,实际上这个过程整整耗费了近半年时间。
基于ES-2-MC2-Hep在腹腔内高效生长及远端多脏器转移的能力,研究人员利用靶向近3000种代谢相关基因的CRISPR sgRNA文库进行了系统性的体内遗传筛选,定义了多个可能介导不同器官转移的代谢基因。你一定听说过近些年基因编辑领域的“宠儿”,CRISPR技术,它可以对DNA进行“剪辑”和修改。由于DNA编码蛋白质,酶又是一种蛋白质、帮助身体化学反应更快进行,因此,通过改动DNA上的基因片段,我们就能控制酶(这些基因和它们对应的蛋白质产物的名称是一一对应的)。
简单来讲,邹贻龙团队利用“基因剪刀”对人体已知的所有代谢相关因子对应的基因片段逐一进行了“去除”,来观察缺失哪个酶,癌细胞转移就无法顺利进行(图4)。
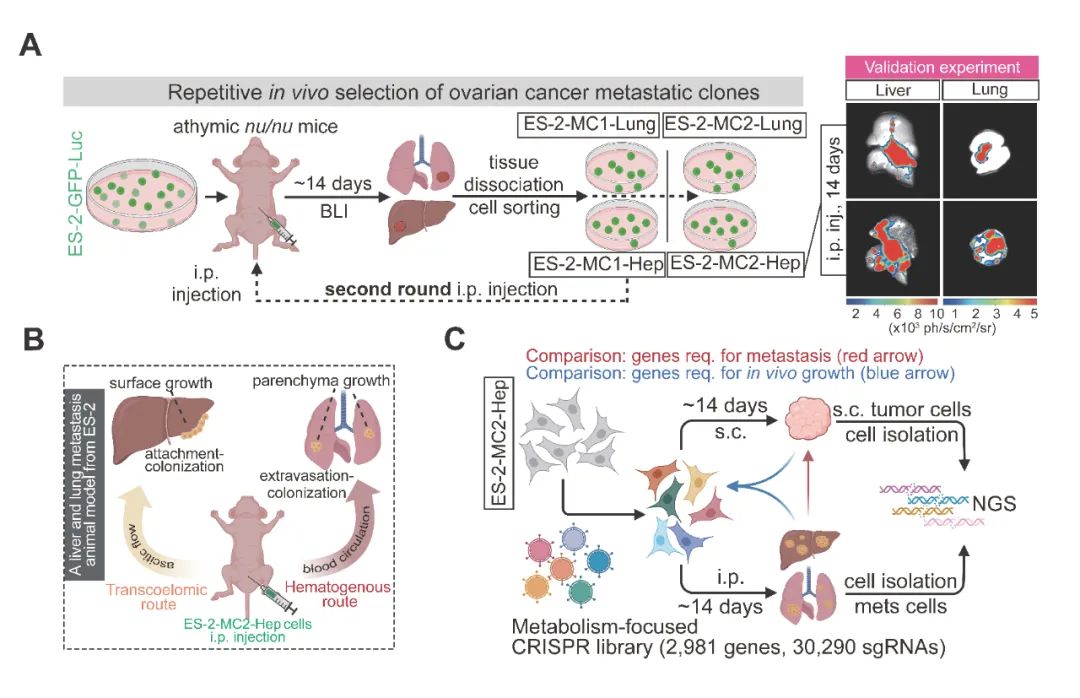
图4. (A) 示意图总结了ES-2远端转移衍生细胞系的体内迭代筛选过程,以及衍生的ES-2-MC2-Hep细胞系肝脏和肺脏转移的代表性BLI图像。(B) 示意图总结了通过腹腔注射ES-2-MC2-Hep细胞所建立的卵巢癌腹腔转移和血运转移过程。(C) 示意图展示了使用靶向代谢酶的sgRNA文库进行体内CRISPR筛选以鉴定ES-2-MC2-Hep转移模型中远端转移调控因子的过程。
在众多可以修改肿瘤转移效率的基因中,团队首先发现NMNAT1是卵巢癌肝脏和肺脏转移的依赖性基因,在卵巢癌腹腔转移和血运转移中的具有重要作用。
之后,他们又发现,脂代谢研究中的“熟面孔”之一,编码调控铁死亡及不饱和脂肪酸代谢的酶ACSL4,竟然也是肺特异性转移中的关键基因!
在脂质代谢中,ACSL4是邹贻龙实验室经常打交道的一种酶。在卵巢癌转移的情景中,他们发现这种酶显著增强了卵巢癌细胞的膜流动性和迁移能力,促进癌细胞的血管外渗,让它们能够通过血管进入周围组织,最终在肺中“驻扎”(图5)。
而癌细胞的血管外渗,即通过血管来进行“远足”转移,常见于诸多类型癌症。这或许意味着ACSL4的功用不单存在于卵巢癌的转移?这一推测很快得到了验证,研究人员在肝癌肺转移模型中发现,ACSL4同样具有促血管外渗作用,提示了这类酶在其他癌症转移过程中或具有功能普适性。
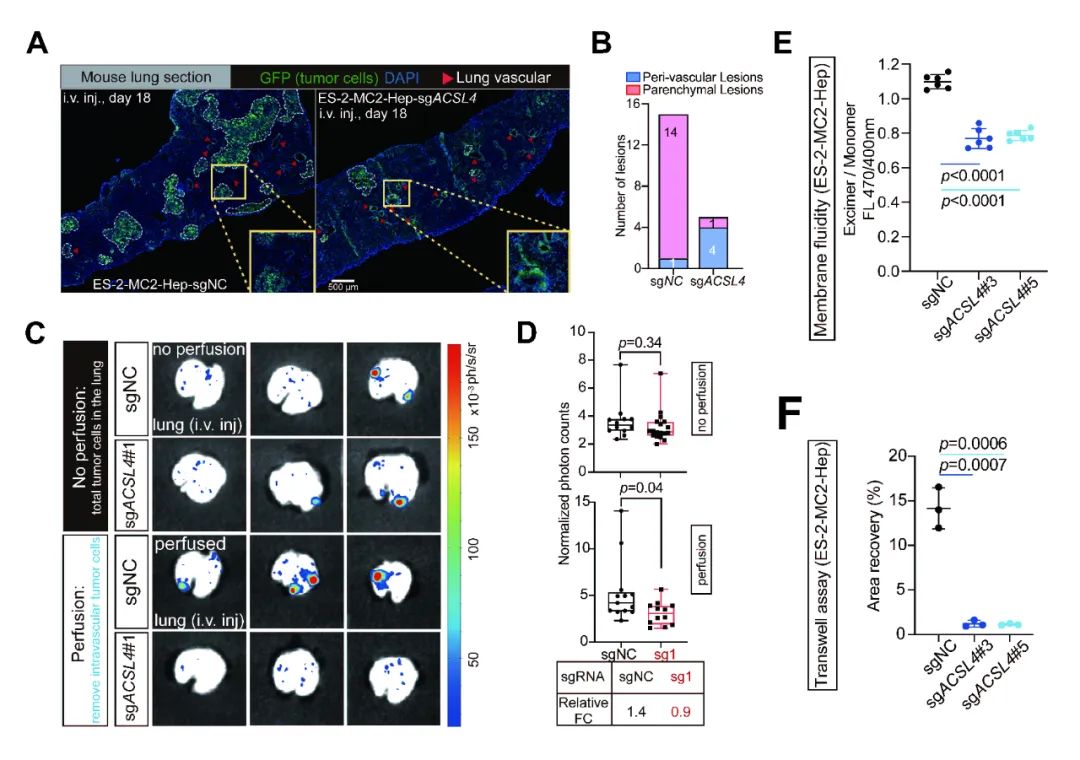
图5. (A) 尾静脉注射所示细胞系后,小鼠肺部切片代表性的免疫荧光图像。(B) 堆叠条形图展示了小鼠尾静脉注射所示细胞系后,肺切片中不同形态转移灶的计数。(C)体内肿瘤外渗实验中,小鼠肺部BLI成像分析的代表性伪彩图像。(D)图C的BLI成像分析中相对光子数的定量分析。(E) 表达所示sgRNA的ES-2-MC2-Hep细胞的膜流动性分析。(F) 表达所示sgRNA的ES-2-MC2-Hep细胞的迁移能力分析。
但邹贻龙团队又发现,ACSL4虽然很关键,却并不是总“有用”。癌细胞转移的过程可以大致分为前期的定植阶段——迁徙到新的位置并“驻扎”下来,与后期的生长阶段——发展壮大。一种可能的解释是,ACSL4在转移的前期定植阶段是必需的,而在后期转移灶的显性生长阶段可能不再被需要。
谁可能是卵巢癌转移后生长阶段的关键基因?研究人员耐心返回CRISPR遗传筛选的结果,重新比较分析了相关数据,找到了由ECI1和ECH1等基因介导的不饱和脂肪酸β-氧化通路。最后经由实验验证,这条脂质通路在调控肿瘤体内增殖和生长过程中发挥着重要作用(图6)。
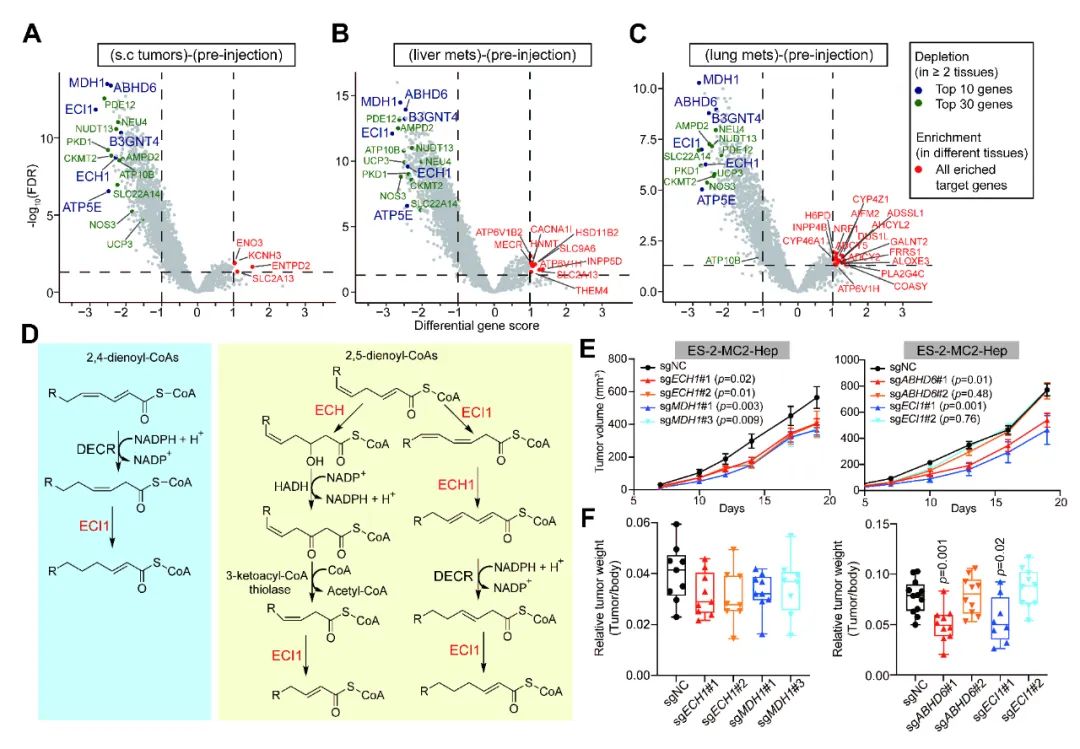
图6.(A-C) 火山图展示了通过比较体内各个位置和脏器生长的肿瘤与注射前肿瘤细胞的sgRNA丰度,鉴定对肿瘤体内生长有贡献的基因。(D) ECI1和ECH1调控的不饱和脂肪酸β-氧化途径的化学反应示意图。(E) 皮下移植表达所示sgRNA的ES-2-MC2-Hep细胞系后,皮下肿瘤的生长曲线图。(F) 皮下移植表达所示sgRNA的ES-2-MC2-Hep细胞系后,皮下肿瘤相对重量的箱线图。
鉴于不饱和脂肪酸代谢在肿瘤细胞血管外渗和体内生长过程中的双重作用,研究人员在多种肿瘤转移模型中联合敲除了ACSL4和ECH1的表达,同时抑制住了肿瘤细胞在远端器官的定植和生长,成功控制了肿瘤细胞整体的血运转移负担(图7)。
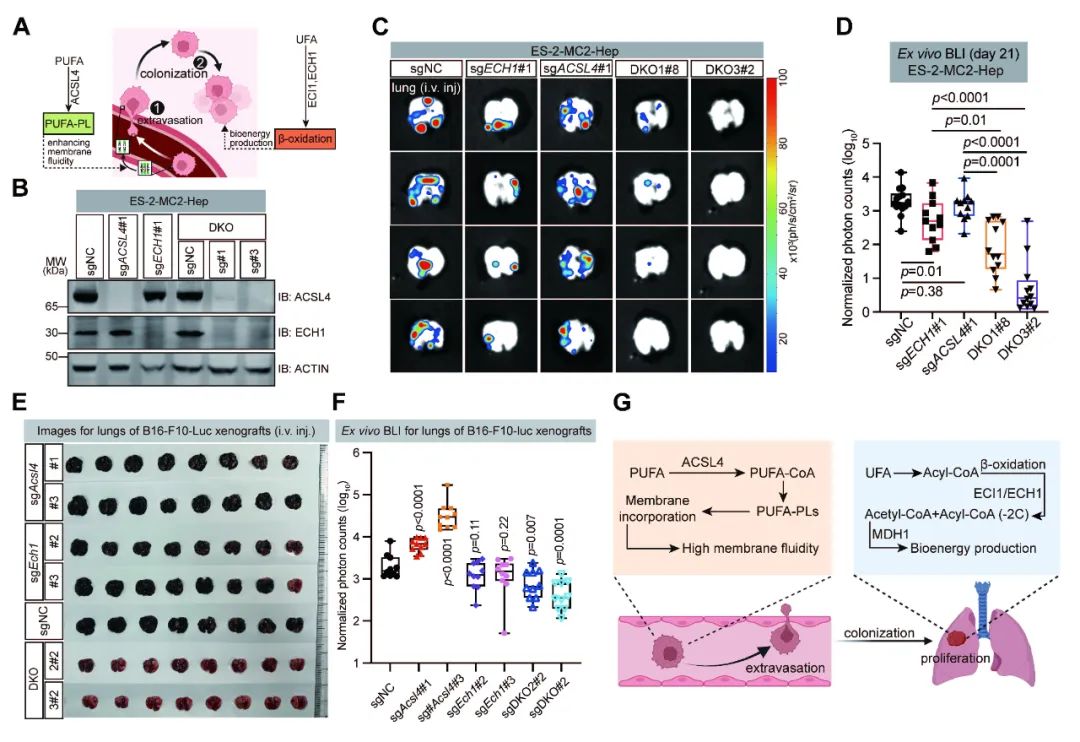
图7.(A) 示意图展示了不饱和脂肪酸代谢在肿瘤转移外渗和定植过程中可能的双重作用。(B) 蛋白免疫印迹显示了表达所示sgRNA的ES-2-MC2-Hep细胞中ACSL4和ECH1的蛋白表达水平。(C-D)尾静脉移植所示细胞系后小鼠肺部BLI成像分析的代表性伪彩图和相对光子数的定量分析。(E-F) 尾静脉移植所示细胞系后小鼠肺部代表性图片和肺部BLI成像相对光子数的定量分析。(G) 示意图展示了不饱和脂肪酸代谢在肿瘤转移外渗和定植过程中的双重作用。
也就是说,他们终于证实了:ACSL4与和ECH1,是影响卵巢癌“远足”中的关键因子!这一结果令研究人员感到欣慰。
这项研究成果,系统性地挖掘了肿瘤转移相关的化合物敏感性,构建了转移瘤相关原代细胞培养体系和动物模型,为肿瘤转移的机制研究提供了资源和模型。同时,它通过体内CRISPR功能基因组学筛选,揭示了多条在肿瘤多路径转移过程中发挥作用的代谢通路,提供了潜在的抗肿瘤转移靶点。它还深入揭示了不饱和脂质代谢通路在肿瘤血运转移中的突出贡献,发现这一作用在多个癌种中的可推广性,为透彻理解肿瘤转移的代谢调控机制提供了新的视角。
这一研究的科学价值和系统性在发表过程中得到了杂志编辑和审稿人的积极支持和专业点拨,这种来自素未谋面的国际同行的认可也让第一作者王煜棋在研究过程中备受鼓舞。回顾历时4年的研究过程,王煜棋分享说: “肿瘤转移的调控因素非常复杂,在研究中我们多次采用无偏的数据挖掘和功能筛选,这一理念帮助我们有效锁定对肿瘤转移贡献最大的生物学过程。”
下一步,研究团队计划在临床转化方面继续进行探索,针对重要的蛋白设计和开发相应的抑制剂,力争让癌症转移患者有药可医。
“好的科学发现总是充满惊喜,成为好的科学家却有规律可循:让好奇心成为你的原动力,大胆地想象和怀疑,不懈地尝试和验证。”这是邹贻龙个人主页最上方的一句话。祝贺这个年轻的团队!期待在不久的将来,他们能给我们带来更多惊喜。
西湖多维动态代谢组学核心实验室主任邹贻龙博士和西湖基因组学与生物信息学核心实验室主任王曦博士为本文的共同通讯作者,西湖实验室助理研究员王煜棋博士、西湖大学博士生胡鋩泽以及南京市妇幼保健院和南京医科大学附属妇产医院曹剑医生为本文的共同第一作者。本研究受到国家科技部重点研发计划、国家自然科学基金面上项目、浙江省“尖兵”&“领雁”项目、西湖实验室、西湖大学未来产业研究中心和西湖教育基金会提供的经费支持。同时,本文感谢西湖大学生物医学实验技术中心、西湖大学实验动物中心提供的多项技术支持。
最新资讯
人物故事
大学新闻
大学新闻
大学新闻

















