
搜索网站、位置和人员

电话: +86-(0)571-86886861 公共事务部
这是一份最好的新年礼物。
北京时间2025年2月20日,西湖大学未来产业研究中心、生命科学学院、西湖实验室卢培龙课题组,在Nature杂志在线发表题为De novo design of transmembrane fluorescence-activating proteins的科研报道——他们首次实现了跨膜荧光激活蛋白的从头设计,这也是第一个通过人工设计得到的能够非共价结合特定小分子的跨膜蛋白1。

论文截图
看到黑色粗体字的文章标题在杂志官网上刷新出来,卢培龙长舒一口气:
“一年了……”
2023年9月,卢培龙初次将这项成果投给Nature。经过漫长的五个月等待,他在龙年春节前夕收到了编辑发来的回复:三位审稿人的意见出现了严重的两极分化。
他沮丧极了,觉得这个年没法过了。
2024年8月,他们完成了审稿人认为“天知道”能不能做成的补充实验,再次将这篇文章投了出去;蛇年春节前夕,终于等来了“即将发表”的好消息。
所以,接下来的内容,不仅要讲这个课题,我们更想讲一讲课题背后的人,讲一讲他们被“磨”了五年、十年,甚至更长时间的故事。
在这个故事里,你将真实地看到:科研的路,不知道需要多少步,但每一步都算数。
https://www.nature.com/articles/s41586-025-08598-8
*复制论文链接或点击文末“阅读原文”可跳转专业版
铺垫
卢培龙很早就盯上了 “跨膜蛋白”。
顾名思义,跨膜蛋白“跨”在细胞膜上,如果将细胞膜看作城墙的话,膜蛋白就是进出城市的城门,细胞内外的物质交换、信息传递,都要通过各种各样的膜蛋白来完成。人类基因组编码的所有蛋白质中,有超过四分之一是膜蛋白。
人体的五种感觉——视觉、听觉、触觉、味觉和嗅觉——都依赖于膜蛋白的关键作用。拿视觉来说,人视网膜视锥细胞中的视紫红质(rhodopsin),是人类直接感受光信号的分子,它结合作为感光基团的视黄醛(retinal),并借助视黄醛分子光致变构的特性,对外界的光信号作出响应,从而使人类能够看见多姿多彩的大千世界。
作为细胞生命活动的核心部件,膜蛋白的功能一旦出现异常,细胞乃至整个生命体的生理活动就容易出问题,各种疾病也便随之而来。目前世界上大约一半现代药物的靶标分子都属于膜蛋白。在许多常见的心血管疾病、精神类疾病,以及更难治疗的癌症、阿尔茨海默症等疾病中,都能够找到与其密切相关的膜蛋白分子,增强或抑制这些膜蛋白的功能,很可能成为治疗疾病的关键。
“那么是否有可能通过人工设计来按需定制全新的、理想的膜蛋白呢?”
它或许可以执行更多更复杂的定制化功能,或许可以更准确地辨别敌友信号,或许可以更高效地进行光合作用……
逢山开路,遇河架桥。大自然没有提供答案的角落,正是想象力和创造力绽放的空间。
大自然中,不同氨基酸序列的肽链能够通过折叠形成不同的结构,从而产生不同的功能;而蛋白质从头设计的过程实际上是将这个流程倒过来,先预设需要的功能和对应的结构,再反推折叠出这个结构所需要的氨基酸序列。

跨膜骨架蛋白质2结构示意图
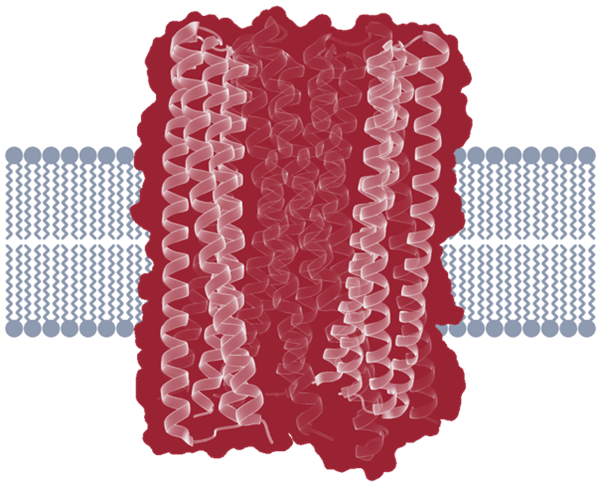
跨膜孔蛋白3结构示意图
10年前,卢培龙加入了华盛顿大学蛋白质设计研究所——也就是2024年诺贝尔化学奖获得者David Baker的课题组——开启了一段长达5年的博士后研究。2018年,也就是入组的第四年,他在世界上首次实现了对多次跨膜蛋白的精确从头设计2。该研究采用了多条螺旋状的结构作为蛋白骨架,与天然存在的跨膜蛋白的常见架构相符合。
这项工作标志着对膜蛋白的精确设计的起步。也因为尚在起步阶段,当时设计的膜蛋白只有结构,没有生理功能。
2019年,卢培龙回国,全职加入西湖大学生命科学学院,组建了自己的课题组——蛋白质设计实验室。2020年8月,Nature报道了由他与David Baker团队合作完成的最新研究——全球首次实现对跨膜孔蛋白的精确从头设计3。
如果说2018年第一步的尝试只是架起了桥,还没有通车;那么这一次的进步就在于,这座桥可以通车了。他们设计的跨膜孔结构,具备了离子、小分子转运通道的功能。
亮了!
这次在Nature发表的新工作,是卢培龙在2019年回国后开展的,一作朱璟熠是2019级博士研究生。他入学的时候,实验室才刚刚“开张”,他跟着卢老师从买试剂买设备开始,想尽快把这个课题启动起来。
他们的目标,是从头设计一种能够特异性地结合某种小分子的跨膜蛋白。这好比在生物膜环境中创造了一个独特的“泊位”,只能允许特定类型的“船舶靠岸”停放。
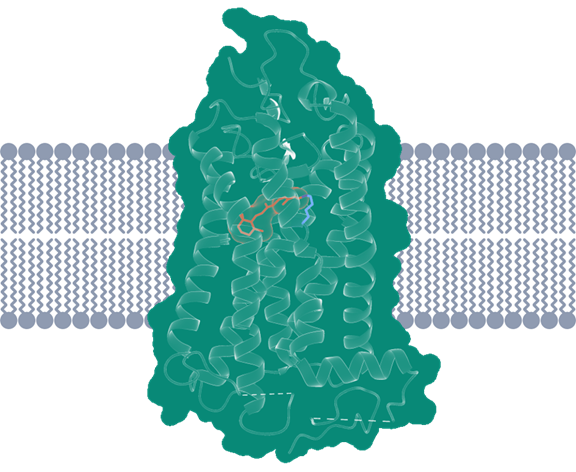
视紫红质三维结构,中心视黄醛分子显示为橙色4。
前面提到的人类直接感受光信号的视紫红质,就是因为具有能够特异结合视黄醛分子的“泊位”,才能够发挥感光的作用。这里“特异结合”的结构,被形象地称为“结合口袋(binding pocket)”。不同膜蛋白的“结合口袋”能够根据其独特的结构,来识别、结合与之相匹配的特定配体,从而实现特定的功能。比如葡萄糖转运蛋白转运葡萄糖分子进入人体细胞,为细胞提供能量;或者NMDA受体被氯胺酮药物分子抑制,对抑郁症起到治疗的作用。
课题组计划在从头设计的蛋白内部也构建一个这样的“口袋”,来特异性地结合目标配体分子。

跨膜荧光激活蛋白结构示意图
作为结合目标的小分子,他们也选好了——一种名叫HBC的荧光基团。这种分子在游离状态下并不会发光,只有当以特定姿态被稳定结合,才能发出荧光。如果成功,这项技术有望广泛应用在膜成像、跨膜传感器、跨膜物质传输等领域。
选择荧光基团作为目标配体分子还有另外一个理由。
在上一次设计“跨膜孔蛋白”的时候,为了验证那些离子究竟是不是从设计好的通道蛋白中透过去的,需要用复杂的测试体系才能得到强有力的证据,这一过程花费了课题组大量的时间。
而如果选择会发光的分子,亮了即代表成功,一目了然。
设计过程分为两步——先设计一个水溶性、不跨膜的简易版;成功后,再将其改造成跨膜蛋白。
研究人员打磨了数不清的设计版本,终于成功构建出了这样一个“口袋”,它不仅成功地结合(点亮)了配体荧光基团HBC599,而且结合后的荧光强度是游离状态的上千倍,远超天然跨膜荧光蛋白。
到这一步,他们花了3年的时间。
三年来,每周一次组会汇报,朱璟熠的电脑里一共存下了上千页PPT。
“因为小分子结合蛋白对精度的要求极高,成功的设计与失败的设计之间,有时只有0.1纳米的偏差。”这个从英国帝国理工学院硕士毕业的小伙子,倒是比导师更沉得住气。“不急,因为随着设计策略的不断改进,我的设计精度一直在不断地提高,趋势是好的。”
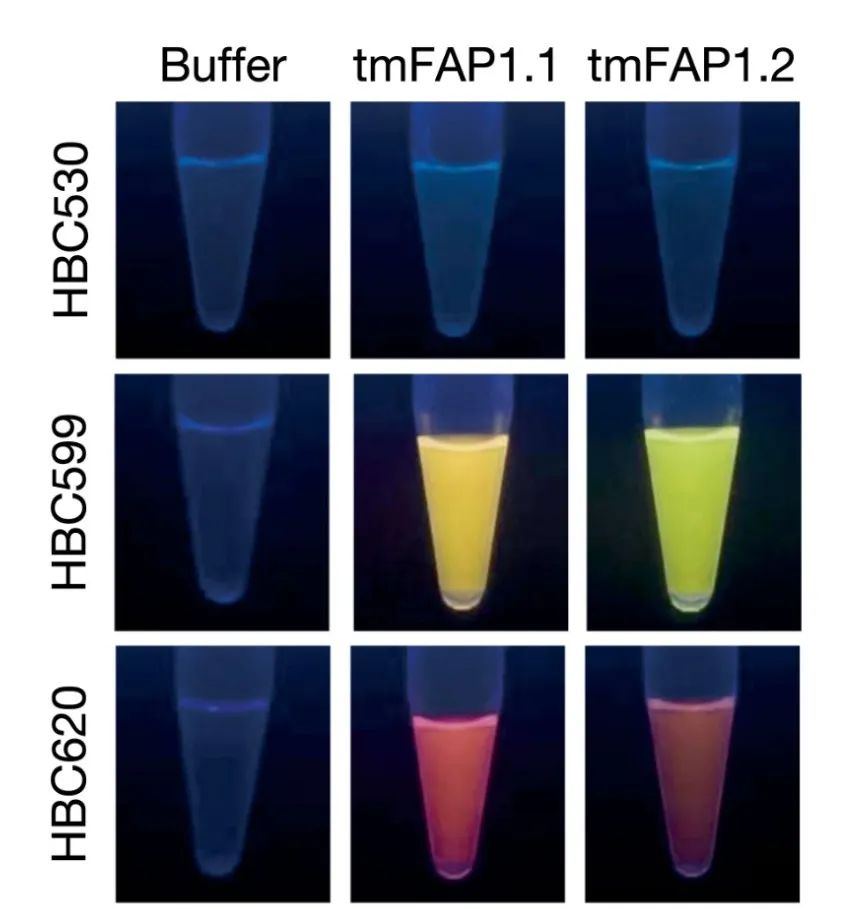
跨膜蛋白选择性激活特定荧光分子
再后来的一年,研究人员们一方面稳住好不容易得来的“口袋”结构,另一方面把蛋白表面从“亲水”设计成“疏水”,最终得到了一个“跨膜”版本的荧光激活蛋白。
这一次足足亮了1600倍!
挫折
“这个领域发展太快了!”
即便做了五年才完成这个课题,但朱璟熠反复挂在嘴边说的,却是这样一句话。
这五年里,技术变化翻天覆地,是动不动就能“上头条”的级别,去年的诺贝尔化学奖也颁发给了这一领域。

David Baker与卢培龙合影
(摄于斯德哥尔摩,2024年12月9日,诺贝尔奖颁奖前一天)
朱璟熠一边做课题,一边前排围观了导师的导师David Baker与人工智能巨头DeepMind在蛋白质结构预测赛道上的你追我赶;同时也见证和参与了人工智能技术对于蛋白质设计领域的革新,在自己的课题里展示了深度学习方法可以被运用到跨膜蛋白计算设计当中,极大地提高了设计的精度和效率。
这波技术跃迁,朱璟熠当然是受益者,但也差点沦为“炮灰”。
2023年9月,卢培龙最后一轮修改完文章,正式向Nature投稿。龙年春节前夕,编辑发回三位匿名审稿人的意见,评价两极化非常严重——
一位说,这是蛋白质设计领域里的杰作(masterpiece of protein design),推荐发表。
另一位评审人则认为,这是一篇很好的工作,第一次解决了领域内非常具有挑战性的问题;同时也提出为了让这项研究“闭环”,应该再补上设计的跨膜蛋白实验结构解析,证明它和设计模型是一致的。
第三个评审意见却是相对负面,同样提出了实验结构验证的问题,但因为蛋白质设计领域的快速发展,这位评审人对之前的研究进展有些误解。
一项快速发展的技术,一个全新的、炙手可热又鲜有先例可循的领域,一个年轻的科学家。这样的组合之下,Nature编辑选择往后退一步,但卢培龙和朱璟熠,不想退。
再投稿
对设计的跨膜荧光蛋白进行实验结构解析,为这个课题保留了一线生机,但也仅仅只有“一线”而已。
冷静下来之后,卢培龙也认可这个审稿意见。“此前确实有很多人尝试设计膜蛋白,也不乏一些有意思的结果,但最大的问题在于它们很难形成稳定的三维结构,缺乏结构上的验证,又或者很难做到实验中获得的结构与设计模型一致。”
事实上,在投稿前几个月,他们已经开始“解结构”了。只是由于这个蛋白质太小了,超过了冷冻电镜解析的极限,课题组也尝试了X-射线晶体学,但是膜蛋白结晶又十分困难。
在加入David Baker实验室之前,卢培龙在清华大学读博士,师从施一公,学的正是结构生物学,这是他的老本行。他甚至有可能是蛋白质设计这个领域里,最清楚跨膜蛋白结构解析有多难的那个人。
显然,那位审稿人也清楚其中的关窍,他的审稿意见里还有这样一句话:“这个结构的实验解析非常具有挑战性,能不能解出来,得看天意(in the lap of the gods)……”
“不管是结构生物学,还是蛋白质设计,我都是在全世界最强的实验室里学的。”卢培龙是这样给自己打气的,最后竟从中觅得了解题思路。“我们的跨膜荧光蛋白太小了,可以用蛋白质设计的方法把它变大呀!”
没想到,在清华大学和华盛顿大学学到的不同的知识,在多年以后产生了如此奇妙的融合,成了决胜的关键。
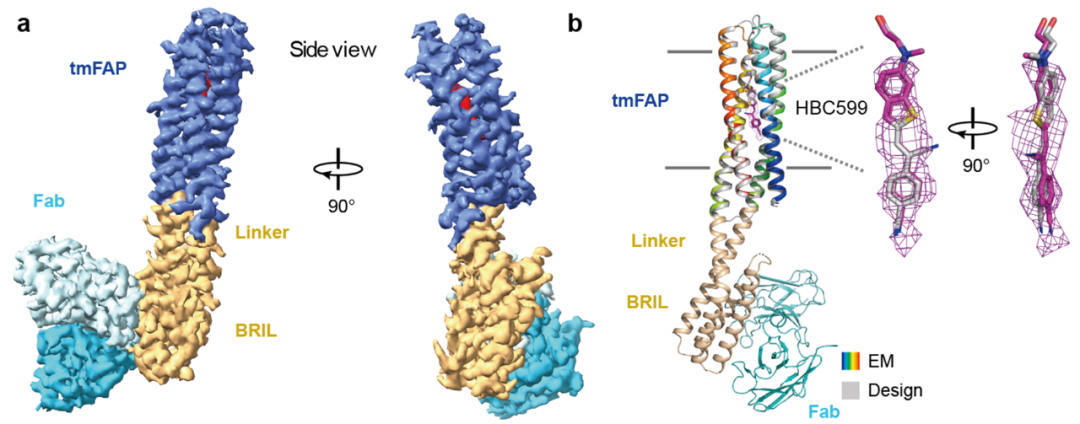
跨膜荧光激活蛋白冷冻电镜结构示意图
2024年9月,距离上一次投稿正好一年。课题组成功解析出设计蛋白与荧光基团复合物的高分辨率冷冻电镜结构,证实其与设计模型高度一致。
卢培龙把修改完善后的文章,再次发给了那位编辑。
这一次,三位审稿人都给出了正面意见。

从头设计跨膜荧光激活蛋白模型
“让最好的技术为我所用,去挑战不可能的事。”卢培龙说。
这是他从施一公和David Baker两位导师身上学到的最重要的一课——敢于做最前沿的研究,敢于挑战别人避之不及的困难——要敢为人先!
致谢

博士生朱璟熠(右一)、梁明福(左二)、孙科(左一)为本文共同第一作者,研究员卢培龙(右二)为通讯作者。
1.J. Zhu et al., De novo design of transmembrane fluorescence-activating proteins. Nature, (2025).
2. P. Lu et al., Accurate computational design of multipass transmembrane proteins. Science 359, 1042-1046 (2018).
3. C. Xu et al., Computational design of transmembrane pores. Nature 585, 129-134 (2020).
4.K. Palczewski et al., Crystal structure of rhodopsin: A G protein-coupled receptor. Science 289, 739-745 (2000).
最新资讯
大学新闻
人物故事
大学新闻

















